
(1)图所示装置为化学实验中常见的仪器,它除了用于洗气外,还有其他用途。![]() 学科网
学科网
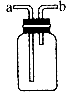
![]() 学科网
学科网
①医院给病人输氧时往往在氧气罐与病人呼吸器之间安装盛水的该装置,通过观察气泡产生情况以便调节供氧速率,此时氧气从 口导入。![]() 学科网
学科网
②实验室用![]() 和浓HCl制
和浓HCl制![]() 实验中,将生成的
实验中,将生成的![]() 通入NaOH溶液之前,先将
通入NaOH溶液之前,先将![]() 从该装置 管进,从 管导出,此时该装置起的作用是防止NaOH倒流。
从该装置 管进,从 管导出,此时该装置起的作用是防止NaOH倒流。![]() 学科网
学科网
③当用此装置收集NO时,需采取什么措施?![]() 学科网
学科网
(2)被称为“魔棒”的荧光棒已成为节日之夜青少年的喜爱之物,其发光原理是利用过氧化氢氧化草酸酯产生能量,该能量被传递给荧光物质后便发出荧光。回答下列问题:![]() 学科网
学科网
①有人说,发光的魔棒不能凑近石油气之类的可燃性气体,否则会导致爆炸,是否正确?说明理由。![]() 学科网
学科网
②通过挤压,使过氧化氢与革酸酯混合反应,导致魔棒发光,一段时间后,光的亮度降低,此时,把魔棒往手心上敲打几下,亮度会重新增大,原因是什么?(提示:草酸酯是一种有较高黏度的有机化合物)![]() 学科网
学科网
③在设计魔棒时,其连续发光的能力在8~12h,如果在发光中途,把它放人冰箱的冷冻室中,发光便会停止或基本停止。把魔棒从冷冻室中取出静止一会儿,它又会连续发光,原因是什么?![]() 学科网
学科网
科目:高中化学 来源: 题型:阅读理解

| x |
| y |
| x |
| y |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
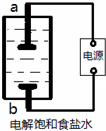 某兴趣小组模拟氯碱工业生产原理并探究其产品的性质.已知文献记载:
某兴趣小组模拟氯碱工业生产原理并探究其产品的性质.已知文献记载:查看答案和解析>>
科目:高中化学 来源: 题型:
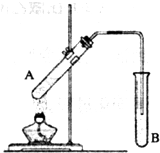 实验室用右图所示装置制取乙酸乙酯.
实验室用右图所示装置制取乙酸乙酯.查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
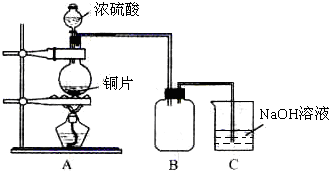
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com