
【题目】下列物质(均为中学化学常见物质)转化关系图中,D为红棕色粉末(反应条件及部分反应物、产物未全部说明),B、C、E为常见单质,A、D为氧化物。
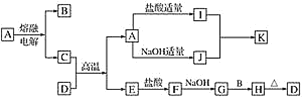
根据图示转化关系填写下列空白:
(1)写出下列物质的化学式A________,B________,G________。
(2)C与D的混合物通常称__________(填名称)。
(3)写出下列化学方程式或离子方程式
①I+J→K________________(离子方程式)。
②G+B→H________________(化学方程式)。
【答案】Al2O3 O2 Fe(OH)2 铝热剂 Al3++3[Al(OH)4]-=4Al(OH)3↓ 4Fe(OH)2+O2+2H2O=4Fe(OH)3
【解析】
由转化关系图可知,电解A得到B与C,A能与盐酸、氢氧化钠反应,则A为两性氧化物Al2O3、C为Al、B为O2;氯化铝溶液和偏铝酸钠溶液反应生成氢氧化铝和氯化钠,则I为AlCl3、J为Na[Al(OH)4]、K为Al(OH)3;D为红棕色粉末,与Al发生铝热反应得到A与E,则D为Fe2O3, E为Fe,;Fe与盐酸反应生成氯化亚铁和氢气,氯化亚铁与氢氧化钠溶液反应生成氢氧化亚铁,氢氧化亚铁与氧气和水反应生成氢氧化铁,氢氧化铁受热分解生成氧化铁和水,则F为FeCl2、G为Fe(OH)2、H为Fe(OH)3。
(1)由上述分析可知,A为Al2O3,E为Fe,G为Fe(OH)2,故答案为:Al2O3;Fe;Fe(OH)2;
(2)铝和氧化铁的混合物通常称为铝热剂,高温下能发生铝热反应生成氧化铝和铁,故答案为:铝热剂;
(3)①I+J→K的反应为氯化铝溶液和偏铝酸钠溶液反应生成氢氧化铝和氯化钠,反应的离子方程式为Al3++3[Al(OH)4]-=4Al(OH)3↓,故答案为:Al3++3[Al(OH)4]-=4Al(OH)3↓;
②G+B→H的反应为氢氧化亚铁与氧气和水反应生成氢氧化铁,反应的化学方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3,故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3。


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列叙述中正确的是
A.常温常压下,48gO3含有的氧原子数为3NA
B.1.8g的NH4+离子中含有的电子数为0.1NA
C.常温常压下,11.2 L氧气所含的原子数为NA
D.2.4g金属镁变为镁离子时失去的电子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
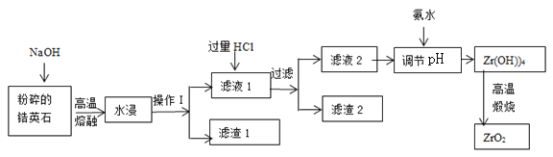
【题目】氧化锆(ZrO2)材料具有高硬度、高熔点、高强度、高韧性、极高的耐磨性及耐化学腐蚀性等优良的物化性能。以锆英石(主要成分为 ZrSiO4,含有少量Al2O3、SiO2、Fe2O3等杂质)为原料通过碱熔法制备氧化锆(ZrO2)的流程如下:
25℃时,有关离子在水溶液中沉淀时的pH数据:
Fe(OH)3 | Zr(OH)4 | Al(OH)3 | |
开始沉淀时pH | 1.9 | 2.2 | 3.4 |
沉淀完全时pH | 3.2 | 3.2 | 4.7 |
请回答下列问题:
(1)流程中旨在提高化学反应速率的措施有________________________________。
(2)操作I的名称是__________________,滤渣1成分为_________,滤渣2的成分为_____________。
(3)锆英石经“高温熔融”转化为Na2ZrO3,写出该反应的化学方程式:____________________。
(4)“调节pH”时,合适的pH范围是__________________。为了得到纯的ZrO2,Zr(OH)4需要洗涤,检验Zr(OH)4是否洗涤干净的方法是__________________。
(5)写出“高温煅烧”过程的化学方程式________________________________。根据ZrO2的性质,推测其一种用途________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,满足表中图示物质在一定条件下一步转化关系的组合有( )
序号 | X | Y | Z | W |
|
① | Si | Na2SiO3 | H2SiO3 | SiO2 | |
② | Na | NaOH | Na2CO3 | NaCl | |
③ | Cl2 | Ca(ClO)2 | HClO | HCl | |
④ | Fe | FeCl3 | FeCl2 | Fe(OH)2 |
A.②③B.①③④C.①④D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某铝合金(硬铝)中含有镁、铜、硅,为了测定该合金中铝的含量,有人设计如下实验:
(1)称取样品ag。
(2)将样品溶于足量稀盐酸中,过滤,滤液中主要含有___离子,滤渣中含有___;在溶解过滤时使用的仪器有___。
(3)往滤液中加入过量NaOH溶液,过滤,写出该步操作中有关的离子方程式____。
(4)在第(3)步的滤液中通入足量CO2过滤,将沉淀用蒸馏水洗涤数次后,烘干并灼烧至质量不再减少为止,冷却后称量,质量为bg。有关反应的化学方程式为____。
(5)计算该样品中铝的质量分数的表达式为___。
(6)若第(3)步中加入NaOH溶液的量不足时,会使测定的结果___(“偏高”“偏低”或“无影响”,下同)。若第(4)步对沉淀的灼烧不充分时,会使测定的结果___。若第(4)步中的沉淀没有用蒸馏水洗涤时,会使测定的结果____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在恒容密闭容器中发生反应NO2(g)+SO2(g) ![]() SO3(g)+NO(g)ΔH= - 41.8 kJmol-1,下列能说明该反应达到平衡状态的是
SO3(g)+NO(g)ΔH= - 41.8 kJmol-1,下列能说明该反应达到平衡状态的是
A.ΔH的数值不再变化B.容器内的压强不再变化
C.气体的颜色不再变化D.气体的密度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“一硫二硝三木炭”描述的是我国四大发明之一的黑火药配方,黑火药爆炸时发生的反应为S+2KNO3+3C ![]() K2S+N2↑+3CO2↑,对于该反应说法不正确的是
K2S+N2↑+3CO2↑,对于该反应说法不正确的是
A. 氧化产物是CO2
B. 爆炸的原因是反应释放大量热,并生成大量气体
C. 反应中有三种元素的化合价发生变化
D. 氧化剂与还原剂的物质的量之比为1:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上由黄铜矿(主要成分 CuFeS2)制取 FeSO4·7H2O 和Cu的主要流程如下:

(1)检验酸浸过程中 Fe2+是否被氧化,应选择________(填字母编号)。
A.KMnO4 溶液 B.K3[Fe(CN)6]溶液 C.KSCN 溶液
(2)酸浸过程中主要反应的化学方程式为__________。
(3)某同学向盛有 H2O2 溶液的试管中加入几滴酸化的 FeSO4 溶液,溶液变成棕黄色,发生反应的离子方程式为___________。一段时间后.溶液中有气泡出现,并放热,随后有红褐色沉淀生成;产生气泡的原因是_________,生成沉淀的原因是___________(用平衡移动原理解释)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaC1O3可用于制取二氧化氯、亚氯酸钠及高氯酸盐等。以原盐(主要成分为NaC1)为原料制备氯酸钠的工艺流程如下:

已知:Cr2O72-+H2O![]() 2CrO42-+2H+。
2CrO42-+2H+。
回答下列问题:
(1)“粗制盐水”中加入NaOH和Na2CO3的目的是___________________。
(2)过滤时,使用的玻璃仪器有烧杯、玻璃棒和____________。
(3)在pH:6.4~6.8,温度:40~50℃的条件下电解,理论上最终产物只有NaC1O3。电解时阳极的产物为C12,溶液中发生的反应有C12+H2O====HC1O+H++C1-,HC1O![]() H++C1O-和__________。
H++C1O-和__________。
(4)电解槽中温度不宜过高,其原因是_________________________。加入的Na2Cr2O7可以调节电解液酸度,若酸度过大,则电解液中主要存在__________(填“Cr2O72-”或“CrO42-”)。
(5)为检测电解后盐水中NaC1O3的物质的量浓度进行下列实验:
I.准确吸取10.00mL电解后的盐水,加入适量的3%H2O2溶液充分搅拌并煮沸。
Ⅱ.准确吸取0.10mol·L-1的(NH4)2Fe(SO4)2标准溶液25.00 mL于300mL锥形瓶中,加入足量稀硫酸。
III.将I的溶液加入Ⅱ的锥形瓶中,隔绝空气煮沸10min,加热充分反应。冷却至室温后,加入10mL0.4mol·L-1MnSO4溶液、5mL 85%磷酸溶液,用c mol·L-1的KMnO4标准溶液滴定剩余的Fe2+至溶液变为微红色,即滴定终点,此时消耗高锰酸钾V mL。
①步骤I中加入H2O2溶液的作用是______________________。
②步骤Ⅱ中C1O3-被Fe2+还原为C1-的离子方程式为________________________。
③该盐水中NaC1O3的物质的量浓度为________mol·L-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com