
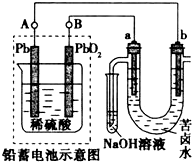
 用铅蓄电池电解苦卤水(含C1-、Br-、Na+、Mg2+)的装置如图所示(a、b为石墨电极).下列说法中正确的是( )
用铅蓄电池电解苦卤水(含C1-、Br-、Na+、Mg2+)的装置如图所示(a、b为石墨电极).下列说法中正确的是( )| A. | 铅蓄电池放电时,该电池两极质量均减小 | |
| B. | 铅蓄电池充电时,B极应与外电源负极相连 | |
| C. | 电解苦卤水时,a电极首先放电的是Cl-而不是Br-,因为Cl-的还原性强于Br- | |
| D. | 当b极产生0.01 mol 气体时,铅蓄电池中消耗0.02 molH2SO4 |
分析 铅蓄电池放电时,铅作负极,二氧化铅作正极,正极上得电子发生还原反应,当铅蓄电池充电时,二氧化铅要连接电源正极;电解苦卤水时,阳极上还原性强的离子先失电子发生氧化反应,根据转移电子相等进行有关计算.
解答 解:A.铅蓄电池放电时,负极和正极上均生成PbSO4,则A、B两极的质量均增加,故A错误;
B.铅蓄电池充电时,B极应与外接电源正极相连,故B错误;
C.电解苦卤水时,阳极上还原性强的离子先失电子发生氧化反应,a电极首先放电的是Br-而不是Cl-,说明当其它条件相同时Br-的还原性强于Cl-,故C错误;
D.忽略能量消耗,b电极上析出氢气,当b极产生0.02g气体时,转移电子的物质的量=$\frac{0.02g}{2g/mol}$,根据Pb+PbO2+4H++2SO42-$?_{充电}^{放电}$2PbSO4+2H2O知,铅蓄电池中消耗0.02mol H2SO4,故D正确;
故选D.
点评 本题考查原电池和电解池原理,根据原电池正负极和电解池阴阳极上得失电子分析解答,难度不大.


 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案科目:高中化学 来源: 题型:选择题
| A. | 月球上的H2O分子中只含有非极性共价键 | |
| B. | H2O在化学反应中既可作氧化剂又可作还原剂 | |
| C. | 氢的三种同位素H、D、T与16O只能形成三种水分子 | |
| D. | 在标准状况下,1mol水的体积约是22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 煤是重要的能源,也是生产化工产品的重要原料.试用所学知识,解答下列问题:
煤是重要的能源,也是生产化工产品的重要原料.试用所学知识,解答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
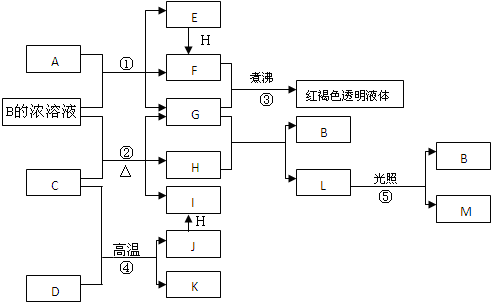
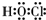 .反应②的化学方程式为PbO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$PbCl2+Cl2↑+2H2O.
.反应②的化学方程式为PbO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$PbCl2+Cl2↑+2H2O.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2FeO4能与水缓慢反应生成Fe(OH)3和O2,故可用作水的消毒剂和净化剂 | |
| B. | 钢铁表面烤蓝生成一层致密的Fe3O4,能起到防腐蚀作用 | |
| C. | 常温下氨能与氯气反应生成氯化氢和氮气,因此可用浓氨水检查氯气管道泄漏情况 | |
| D. | 开发利用可燃冰(固态甲烷水合物),有助于海洋生态环境的治理 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
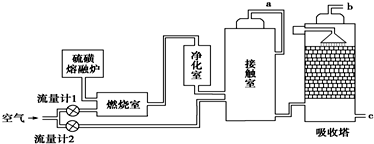
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
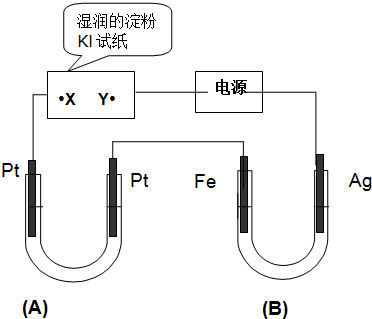
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标况下11.2LSO3含有的分子数为0.5 NA | |
| B. | 标况下1mol氖气含有的原子数为2NA | |
| C. | 常温常压71gCl2所含原子数为NA | |
| D. | 17g氨气所含电子数目为10NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com