
| A. | 若原料完全反应成上述产物,CH3CH2Br与NH3的物质的量之比为2:1 | |
| B. | CH3CH2Br和HBr均属于电解质 | |
| C. | 该反应属于取代反应 | |
| D. | CH3CH2Br难溶于水 |
分析 CH3CH2Br与NH3反应生成(CH3CH2)2NH和HBr,方程式为:2CH3CH2Br+NH3→2(CH3CH2)2NH+2HBr,CH3CH2Br中的溴原子被氢原子取代,卤代烃难溶于水,属于非电解质;
解答 解:A.2CH3CH2Br+NH3→2(CH3CH2)2NH+2HBr,CH3CH2Br与NH3的物质的量之比为2:1,故A正确;
B.CH3CH2Br属于非电解质,HBr均属于电解质,故B错误;
C.CH3CH2Br中的溴原子被氢原子取代,属于取代反应,故C正确;
D.CH3CH2Br难溶于水,故D正确,
故选B.
点评 本题以化学反应考查有机物的性质、有机反应类型,题目较为简单,注意理解常见有机反应类型,注意取代反应与其它反应类型的区别.


科目:高中化学 来源: 题型:选择题
| A. | 全部 | B. | ③④ | C. | ②④ | D. | ①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 醋酸与水以任意比例互溶 | |
| B. | 10 mL 1 mol•L-1醋酸恰好与10 mL 1 mol•L-1NaOH溶液完全反应 | |
| C. | 1 mol•L-1的醋酸溶液的c(H+)约为0.01 mol•L-1 | |
| D. | 在相同浓度下,醋酸的导电性比一元强酸溶液的弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X是非金属元素 | |
| B. | X形成含氧酸钾盐化学式可能为KXO2、KXO3或KXO4 | |
| C. | 由X形成的含氧酸均为强酸 | |
| D. | X不可能为第一周期元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
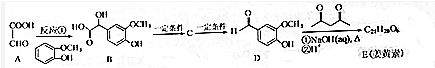
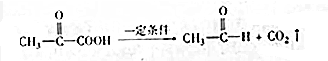


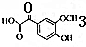
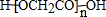
 ,
,查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 钍试剂滴定法测定烟气中SO3、SO2含量的装置如图所示.
钍试剂滴定法测定烟气中SO3、SO2含量的装置如图所示.| 吸收瓶 | 1 | 2 | 3 |
| 试剂 | 50mL | ||
| 异丙醇 | 50mL 6.8% | ||
| H2O2溶液 | 50mL 6.8% | ||
| H2O2溶液 | |||
| 目的 | 吸收SO3 | 吸收SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
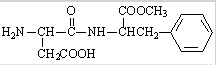 关于该有机物的说法不正确的是( )
关于该有机物的说法不正确的是( )| A. | 在适当催化剂作用下可形成高分子化合物 | |
| B. | 该有机物完全燃烧时生成CO2、H2O、NH3 | |
| C. | 1mol该有机物在盐酸中发生水解反应时最多消耗2molH+ | |
| D. | 1mol该有机物最多能与3molNaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定温度下,将氨水稀释,NH3?H2O 的电离度增大,H2O 的电离度也增大 | |
| B. | 水中加酸加碱都会阻碍水的电离,所以 c(H+)?c(OH-)<10-14 | |
| C. | 水中加酸,阻碍水的电离,所以 c(H+)=c(OH-)<10-7 mol•L-1 | |
| D. | 醋酸溶液加水稀释,溶液中所有微粒的浓度都会降低 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com