
【题目】某小组在验证反应“Fe+2Ag+=Fe2++2Ag”的实验中检测到Fe3+ , 发现和探究过程如下.
向硝酸酸化的0.05molL﹣1硝酸银溶液(pH≈2)中加入过量铁粉,搅拌后静置,烧杯底部有黑色固体,溶液呈黄色.
(1)检验产物
①取少量黑色固体,洗涤后,(填操作和现象),证明黑色固体中含有Ag.
②取上层清液,滴加K3[Fe(CN)6]溶液,产生蓝色沉淀,说明溶液中含有 .
(2)针对“溶液呈黄色”,甲认为溶液中有Fe3+ , 乙认为铁粉过量时不可能有Fe3+ , 乙依据的原理是(用离子方程式表示).针对两种观点继续实验:
①取上层清液,滴加KSCN溶液,溶液变红,证实了甲的猜测.同时发现有白色沉淀产生,且溶液颜色变浅、沉淀量多少与取样时间有关,对比实验记录如下:
序号 | 取样时间/min | 现象 |
ⅰ | 3 | 产生大量白色沉淀;溶液呈红色 |
ⅱ | 30 | 产生白色沉淀;较3min时量小;溶液红色较3min时加深 |
ⅲ | 120 | 产生白色沉淀;较30min时量小;溶液红色较3 0min时变浅 |
(资料:Ag+与SCN﹣生成白色沉淀AgSCN)
②对Fe3+产生的原因作出如下假设:
假设a:可能是铁粉表面有氧化层,能产生Fe3+;
假设b:空气中存在O2 , 由于(用离子方程式表示),可产生Fe3+;
假设c:酸性溶液中NO3﹣具有氧化性,可产生Fe3+;
假设d:根据现象,判断溶液中存在Ag+ , 可产生Fe3+ .
③下列实验Ⅰ可证实假设a、b、c不是产生Fe3+的主要原因.实验Ⅱ可证实假设d成立.
实验Ⅰ:向硝酸酸化的溶液(pH≈2)中加入过量铁粉,搅拌后静置,不同时间取上层清液滴加KSCN溶液,3min时溶液呈浅红色,30min后溶液几乎无色.
实验Ⅱ:装置如图.其中甲溶液是 , 操作现象是 . 
(3)根据实验现象,结合方程式推测实验ⅰ~ⅲ中Fe3+浓度变化的原因: .
【答案】
(1)加入足量加入足量稀盐酸(或稀硫酸)酸化,固体未完全溶解;Fe2+
(2)Fe+2Fe3+=3Fe2+;4Fe2++O2+4H+=Fe3++2H2O;白色沉淀;NaNO3;FeCl2/FeCl3;按图连接好装置,电流表指针发生偏转
(3)i→ii Ag++Fe2+=Ag+Fe3+ , 反应生成Fe3+ , 使Fe3+增加,红色变深,ii→iii 空气中氧气氧化SCN﹣ , 红色变浅
【解析】解:(1)①黑色固体中含有过量铁,如果同时含有银,则可以加入HCl或H2SO4溶解Fe,而银不能溶解,
故答案为:加入足量加入足量稀盐酸(或稀硫酸)酸化,固体未完全溶解;
②K3[Fe(CN)3]是检验Fe2+的试剂,所以产生蓝色沉淀说明含有Fe2+ ,
故答案为:Fe2+;(2)过量铁粉与Fe3+反应生成Fe2+ , 即Fe+2Fe3+=3Fe2+ ,
故答案为:Fe+2Fe3+=3Fe2+;
②O2氧化Fe2+反应为4Fe2++O2+4H+=Fe3++2H2O,白色沉淀是AgSCN,所以实验可以说明含有Ag+ , Ag+可能氧化Fe2+生成Fe3+ ,
故答案为:4Fe2++O2+4H+=Fe3++2H2O;白色沉淀;
③证明假设abc错误,就是排除Ag+时实验比较,相当于没有Ag+存在的空白实验,考虑其他条件不要变化,可以选用NaNO3 , 原电池实验需要证明的是假设d的反应Ag++Fe2+=Ag+Fe3+能够实现,所以甲池应当注入FeCl2、FeCl3混合溶液,按图连接好装置,如电流表指针发生偏转,可说明d正确,
故答案为:NaNO3;FeCl2/FeCl3;按图连接好装置,电流表指针发生偏转;(3)i→iii中Fe3+变化的原因:i→ii Ag++Fe2+=Ag+Fe3+ , 反应生成Fe3+的使Fe3+浓度增加,ii→iii 溶液红色较3 0min时变浅,说明空气中氧气氧化SCN﹣ , 使平衡向生成Fe3+的方向移动,Fe(SCN)3浓度减小,则溶液的颜色变浅,
故答案为:i→ii Ag++Fe2+=Ag+Fe3+ , 反应生成Fe3+的使Fe3+增加,红色变深,ii→iii 空气中氧气氧化SCN﹣ , 红色变浅.
(1)银和盐酸、稀硫酸等不反应,可用K3[Fe(CN)3]检验亚铁离子,生成蓝色沉淀;(2)过量的铁与硝酸反应生成亚铁离子,亚铁离子可被空气中氧气氧化,银离子如氧化亚铁离子,则发生Ag++Fe2+=Ag+Fe3+ , 如反应能发生,可设计成原电池,负极加入FeCl2/FeCl3 , 正极为硝酸银,可根据电流计是否发生偏转判断;(3)取上层清液,滴加KSCN溶液,溶液变红,可证明溶液中有Fe3+ , 生成白色沉淀为AgSCN,随着放置时间的增加,溶液红色变浅,可能为空气中氧气氧化SCN﹣ , 以此解答该题.


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
【题目】下面是某化学研究小组探究外界条件对化学反应速率和化学平衡影响的图像,其中图像和实验结论表达均正确的是( ) 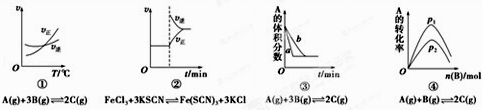
A.①是其他条件一定时,反应速率随温度变化的图像,正反应△H<0
B.②是在平衡体系的溶液中溶入少量KCl晶体后化学反应速率随时间变化的图像
C.③是在有无催化剂存在下建立的平衡过程图像,a是使用催化剂时的曲线
D.④是一定条件下,向含有一定量A的容器中逐渐加入B时的图像,压强p1>p2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示一些晶体中的某些结构,它们分别是NaCl、干冰、金刚石、石墨结构中的某一种的某一部分。
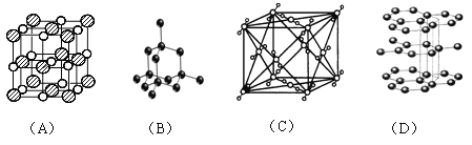
(1)其中代表金刚石的是(填编号字母,下同)_____,金刚石属于_____晶体。
(2)其中代表石墨的是_________,其晶体中碳原子呈平面_________结构排列。
(3)其中代表NaCl的是_________,晶体中Na+与Cl-之间通过__________键结合起来。
(4)代表干冰的是_______,它属于_______晶体,CO2分子间通过_____________结合起来。
(5)上述物质中(A)(B)(C)三者的熔点由高到低的排列顺序为_______________。(填编号字母)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】支撑海港码头基础的钢管柱,常用外加电流的阴极保护法进行防腐,工作原理如图所示,其中高硅铸铁为惰性辅助阳极.下列有关表述不正确的是( )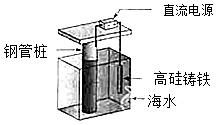
A.通入保护电流使钢管桩表面腐蚀电流接近于零
B.通电后外电路电子被强制从高硅铸铁流向钢管桩
C.高硅铸铁的作用是作为损耗阳极材料和传递电流
D.通入的保护电流应该根据环境条件变化进行调整
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在强碱性溶液中能大量共存,并且溶液为无色透明的离子组是
A.Na+、Mg2+、NO3-、Cl- B.K+、Na+、CO32-、NO3-
C.K+、Ba2+、HCO3-、Cl- D.Na+、K+、MnO4-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的量浓度相同的NaCl、MgCl2、AlCl3三种溶液,当溶液的体积比为3:2:1时,则三种溶液中Cl-的物质的量之比为( )
A. 3:4:3 B. 1:2:3 C. 3:2:1 D. 1:1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能正确表达下列反应的离子方程式为( )
A.用醋酸除去水垢:2H++CaCO3=Ca2++CO2↑+H2O
B.硫化亚铁与浓硫酸混合加热:2H++FeS=H2S↑+ Fe2+
C.向硫酸铝溶液中滴加碳酸钠溶液:2Al3++3 ![]() =Al2(CO3)3↓
=Al2(CO3)3↓
D.用氢氧化钠溶液吸收工业废气中的NO2:2NO2+2OH= ![]() +
+ ![]() + H2O
+ H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对放热反应:A+B═C+D,以下说法一定正确的是(EA、EB、EC、ED分别表示物质A,B,C,D所具有的能量)( )
A.EA>EB
B.EA>EB+EC
C.EA+EB>EC+ED
D.EA+EB<EC+ED
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com