
 ��I
��I SO2����ԭ����ǿ����˳������Ϊ ��
SO2����ԭ����ǿ����˳������Ϊ ��  Na2CO3+ CO2��+ H2O��2mol��NaHCO3���ȷֽ�õ�1mol CO2��1molH2O . 1mol H2O������Ӧ2Na2O2+2H2O=4NaOH+O2��������Na2O21mol ����2mol NaOH .�ٷ�����Ӧ2NaOH+ CO2= 2Na2CO3 +H2O���ۺ������൱�ڷ���2Na2O2+2CO2=2Na2CO3+O2����Na2O21mol,����Na2CO31mol�������õ��Ĺ���ΪNa2CO3��
Na2CO3+ CO2��+ H2O��2mol��NaHCO3���ȷֽ�õ�1mol CO2��1molH2O . 1mol H2O������Ӧ2Na2O2+2H2O=4NaOH+O2��������Na2O21mol ����2mol NaOH .�ٷ�����Ӧ2NaOH+ CO2= 2Na2CO3 +H2O���ۺ������൱�ڷ���2Na2O2+2CO2=2Na2CO3+O2����Na2O21mol,����Na2CO31mol�������õ��Ĺ���ΪNa2CO3��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
A�� Ce�� Ce�� Ce�� Ce��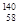 Ce�� Ce�� Ce���ǻ���Ϊͬ�������� Ce���ǻ���Ϊͬ�������� |
| B����ҵ�Ͽ��Բ��õ���Ȼ���ˮ��Һ������浥�� |
| C����������������Ҫ��ѧ����ʽ�ɱ�ʾΪ2Ce��6HI=2CeI3��3H2�� |
| D����ҵ�Ͻ�����һ�㱣���ڳ��������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A���ö��Ե缫���Ce��SO4��2��Һ��������������� |
| B���������ĵ⻯������Һ�μӵ�Ce��SO4��2��Һ�У������ӷ���ʽΪCe4����Fe2��=Ce3����Fe3�� |
| C���������Ż�ʱ������ɳ������ |
| D��������ɽ���ú���б��棬������������ͨ��ĵط���ҪԶ����ֺ���Դ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
A�������������Ļ�ѧ����ʽ�ɱ�ʾΪ��Ce + 4HI  CeI4 + 2H2�� CeI4 + 2H2�� |
| B����Ce(SO4)2��Һ�ζ�����������Һ�������ӷ���ʽΪ��Ce4+ + 2Fe2+ = Ce3+ + 2Fe3+ |
| C����һ�������£��������״̬��CeO2��Ce������������� |
| D��������ֺ���13658Ce��13858Ce��14058Ce��14258Ce�����ǻ���Ϊͬ�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��H2O2�������Ա�Fe3��ǿ���仹ԭ�Ա�Fe2���� |
| B���ڷ�Ӧ�����У���Һ��pH�������� |
| C���ڷ�Ӧ�����У�Fe2����Fe3�����������ֲ��� |
| D��H2O2��������Ҫ�ϸ�������Fe2�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��ԭ��Һ��c��Br����=0��4mol/L | B����Ӧ����Һ��c��Fe3+��=c��Fe2+�� |
| C����Ӧ����Һ��c��Fe3+��=0��1mol/L | D��ԭ��Һ��Ũ��Ϊ0��1mol/L |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��Zn2����Fe3����Cu | B��Cu2����Fe3����Zn |
| C��Zn2����Cu2����Fe2����Fe | D��Zn2����Fe2����Cu2����Cu |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��NaIO3���������� HSO3-�ǻ�ԭ�� |
| B�������пɵõ�������H2SO4��Na2SO4 |
| C��I2���������������ǻ�ԭ���� |
| D��HSO3-�Ļ�ԭ�Ա�I-�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com