
| ||
| 高温高压 |
| ||
| 高温高压 |
| ||
| 高温高压 |
| ||
| 高温高压 |


科目:高中化学 来源: 题型:
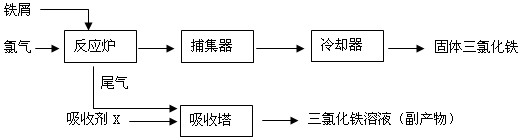
| ||
| ||
| 温度/℃ | 0 | 10 | 20 | 30 | 50 | 80 | 100 |
| 溶解度/g | 74.4 | 81.9 | 91.8 | 106.8 | 315.1 | 525.8 | 535.7 |
| 162.5cV |
| m |
| 162.5cV |
| m |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (2009?重庆)工业上电解饱和食盐能制取多种化工原料,其中部分原料可用于制备多晶硅.
(2009?重庆)工业上电解饱和食盐能制取多种化工原料,其中部分原料可用于制备多晶硅.
| ||
| ||
 4SiHCl3(g)达平衡后,H2与SiHCl3物质的量浓度分别为0.140mol/L和0.020mol/L,若H2全部来源于离子交换膜法的电解产物,理论上需消耗纯NaCl的质量为
4SiHCl3(g)达平衡后,H2与SiHCl3物质的量浓度分别为0.140mol/L和0.020mol/L,若H2全部来源于离子交换膜法的电解产物,理论上需消耗纯NaCl的质量为查看答案和解析>>
科目:高中化学 来源: 题型:
| [CH3OH] |
| [CO][H2]2 |
| [CH3OH] |
| [CO][H2]2 |

| b-a-4c |
| 2 |
| b-a-4c |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
| ||
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com