
| A. | 苯酚沾在手上应立即用酒精洗涤 | |
| B. | 将铜丝在酒精灯上加热后,立即伸入无水乙醇中,铜丝恢复成原来的红色 | |
| C. | 点燃甲烷、乙烯等可燃性气体前必须先检验其纯度 | |
| D. | 在苯酚溶液中滴入少量稀溴水出现白色沉淀 |
分析 A.苯酚易溶于酒精;
B.加热条件下,氧化铜可与乙醇发生氧化还原反应;
C.不纯的可燃气体点燃时易爆炸;
D.在苯酚溶液中滴入少量稀溴水,生成的三溴苯酚易溶于苯酚.
解答 解:A.苯酚具有腐蚀性,易溶于酒精,可用酒精洗涤,故A正确;
B.加热条件下,氧化铜可与乙醇发生氧化还原反应,反应生成铜和乙醛,则铜丝恢复成原来的红色,故B正确;
C.不纯的可燃气体点燃时易爆炸,则点燃时应先验纯,故C正确;
D.在苯酚溶液中滴入少量稀溴水,生成的三溴苯酚易溶于苯酚,观察不到白色沉淀生成,故D错误.
故选D.
点评 本题考查化学实验方案的评价以及有机物的结构和性质,为高频考点,侧重考查学生的分析能力和实验能力,注意把握实验的严密性和可行性的评价,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 同系物的化学性质一定相似 | |
| B. | 卤代烃在氢氧化钠醇溶液中共热均能发生消去反应 | |
| C. | 1mol醛与银氨溶液反应只能还原出2molAg | |
| D. | 在催化剂作用下,丙醛、丙酮、丙酸均能与氢气发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
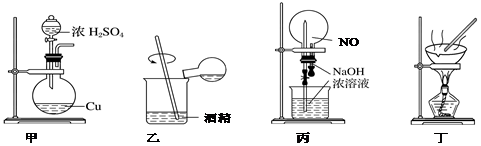
| A. | 用图甲做铜与浓硫酸反应制取SO2 | |
| B. | 用图乙配制浓硫酸与酒精的混合液 | |
| C. | 用图丙做NO与NaOH溶液的“喷泉”实验 | |
| D. | 用装置丁做蒸发CuCl2溶液获得CuCl2•2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-5 | 6×10-5 | 2×10-4 | 4×10-4 | 3×10-4 | 2×10-4 |
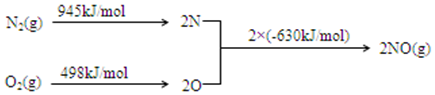
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
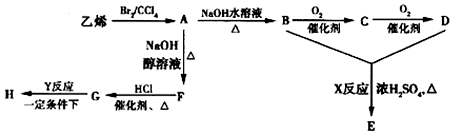
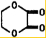 +2H2O;
+2H2O; +2NaOH$\stackrel{△}{→}$NaOOCCOONa+HOCH2CH2OH.
+2NaOH$\stackrel{△}{→}$NaOOCCOONa+HOCH2CH2OH.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素的性质随着相对原子质量的递增而呈周期性变化 | |
| B. | 元素的性质随着原子序数的递增而呈周期性变化 | |
| C. | 周期表中的主族中都既有非金属元素又有金属元素 | |
| D. | 原子的最外层电子数相同的元素,一定属于同一族 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烷与氯气光照反应可以制得较纯净的1,2-二氯乙烷 | |
| B. | 苯中的化学键都是非极性键 | |
| C. | 煤的干馏属于物理变化 | |
| D. | 涤纶、酚醛树脂和蛋白质都属于高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间(s) 浓度(mol/L) | 0 | 1 | 2 | 3 | 4 | 5 |
| c(CO) | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
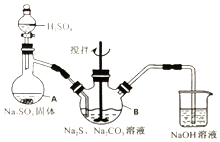 硫代硫酸钠(Na2S2O3•5H2O)俗名“大苏打”,又称为“海波”.它易溶于水,难溶于乙醇,加热、遇酸均易分解.某实验室模拟工业硫化碱法制取硫代硫酸钠,其反应装置及所需试剂如图:
硫代硫酸钠(Na2S2O3•5H2O)俗名“大苏打”,又称为“海波”.它易溶于水,难溶于乙醇,加热、遇酸均易分解.某实验室模拟工业硫化碱法制取硫代硫酸钠,其反应装置及所需试剂如图:| 编号 | 1 | 2 | 3 |
| 溶液的体积/mL | 10.00 | 10.00 | 10.00 |
| 消耗I2标准溶液的体积/mL | 19.98 | 22.50 | 20.02 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com