
| A. | 纯净物C4H8的核磁共振氢谱峰最多为4 | |
| B. | 化学式为C8H8的有机物,一定能使酸性高锰酸钾溶液褪色 | |
| C. | 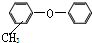 的同分异构体中,可以有醇、酚类物质 的同分异构体中,可以有醇、酚类物质 | |
| D. | 1 mol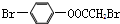 最多能与2 mol NaOH反应 最多能与2 mol NaOH反应 |
分析 A.C4H8最多有4种不同的H;
B.化学式为C8H8的有机物,如立方烷,不能与高锰酸钾反应;
C.有机物中只含有1个O原子,可能为醇、酚类物质;
D.1mol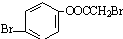 水解产物中含有2mol酚羟基、1mol羧基和2molHBr.
水解产物中含有2mol酚羟基、1mol羧基和2molHBr.
解答 解:A.C4H8如为CH2=CHCH2CH3,多有4种不同的H,故A正确;
B.化学式为C8H8的有机物,如立方烷,不能与高锰酸钾反应,故B错误;
C.有机物中只含有1个O原子,可能为醇、酚类物质,故C正确;
D.1mol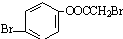 水解产物中含有2mol酚羟基、1mol羧基和2molHBr,则最多与5molNaOH反应,故D错误.
水解产物中含有2mol酚羟基、1mol羧基和2molHBr,则最多与5molNaOH反应,故D错误.
故选AC.
点评 本题考查有机物的结构和性质,题目难度不大,注意把握有机物的官能团的性质,能判断有机物的结构特征,易错点为D,注意有机物水解产物的判断.


科目:高中化学 来源: 题型:选择题
| A. | Fe3+、NH4+、SCN-、C1- | B. | Na+、Br-、NH4+、SO42- | ||
| C. | Na+、HCO3-、K+、CO32- | D. | Fe2+、NH4+、C1-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
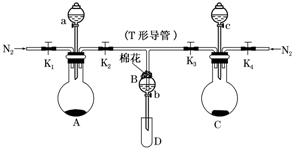 某实验小组用如图所示装置进行实验以探究Fe3+、Cl2和SO2的氧化性强弱(夹持仪器已略).
某实验小组用如图所示装置进行实验以探究Fe3+、Cl2和SO2的氧化性强弱(夹持仪器已略).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常见铅蓄电池放电时,负极质量减轻,正极质量增加 | |
| B. | 电解法精炼铜时,以粗铜作阴极,纯铜作阳极 | |
| C. | 常温下,pH=5的盐酸稀释1000倍后,溶液的pH=8 | |
| D. | 水的离子积随温度升高而增大,说明水的电离是吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 目前工业上制备丙烯腈(CH2=CHC≡N)有乙炔法、丙烯氨氧化法等.
目前工业上制备丙烯腈(CH2=CHC≡N)有乙炔法、丙烯氨氧化法等.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HAt很稳定 | B. | At是有色固体 | ||
| C. | At易溶于有机溶剂 | D. | AgAt不溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
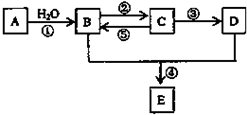 A、B、C、D、E(部分反应条件、产物被省略).其中A是一种重要的化工材料,它的产量可以用来衡量一个国家的石油化工水平;B和D式生活中两种常用的有机物;E是具有果香气味的烃的衍物.
A、B、C、D、E(部分反应条件、产物被省略).其中A是一种重要的化工材料,它的产量可以用来衡量一个国家的石油化工水平;B和D式生活中两种常用的有机物;E是具有果香气味的烃的衍物.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com