
时间(h) 钾元素 温度熔出率 | 1.5 | 2.5 | 3.0 | 3.5 | 4.0 |
| 830℃ | 0.481 | 0.575 | 0.626 | 0.669 | 0.685 |
| 890℃ | 0.579 | 0.691 | 0.694 | 0.699 | 0.699 |
| 950℃ | 0.669 | 0.714 | 0.714 | 0.714 | 0.714 |
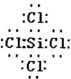 ,
, ;
;| 0.699mol×58.5g/mol |
| 556g |


 考前必练系列答案
考前必练系列答案科目:高中化学 来源:不详 题型:单选题
| A.O2、O3互为同位素 |
| B.1H、2H、3H、H+、H2是氢元素形成的五种不同粒子 |
| C.正丁烷和异丁烷互为同系物 |
| D.乙烷、乙烯互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.还原性:As3->S2->Cl- |
| B.热稳定性:HCl>AsH3>HBr |
| C.原子半径:As>Cl>P |
| D.酸性:H3AsO4>H2SO4>H3PO4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.碱性:NaOH>Mg(OH)2 |
| B.金属性:K>Na |
| C.气态氢化物稳定性:HF>HCl>H2S |
| D.原子半径:Cl>S |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com