
下列叙述正确的是 ( )。
A.金属受外力作用时常常发生变形而不易折断,是由于金属原子之间有较
强的作用
B.通常情况下,金属里的自由电子会发生定向移动而形成电流
C.金属是借助自由电子的运动,把能量从温度高的部分传到温度低的部分
D.金属的导电性随温度的升高而减弱
科目:高中化学 来源: 题型:
高温下,某反应达平衡,平衡常数K=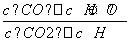 ,恒容时,温度升高,H2浓度减小。下列说法正确的是( )
,恒容时,温度升高,H2浓度减小。下列说法正确的是( )
A.该反应的焓变为正值
B.恒温恒容下,增大压强,H2浓度一定减小
C.升高温度,逆反应速率减小
D.该反应化学方程式为CO+H2O===CO2+H2
查看答案和解析>>
科目:高中化学 来源: 题型:
工程塑料PBT的结构简式为
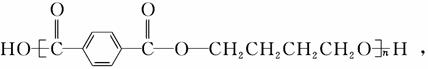 下列有关PBT的说法正确的是 ( )。
下列有关PBT的说法正确的是 ( )。
A.PBT是加聚反应得到的高分子化合物
B.PBT分子中含有羧基、羟基和酯基
C.PBT的单体中有芳香烃
D.PBT的单体均能与Na、NaOH、Na2CO3反应
查看答案和解析>>
科目:高中化学 来源: 题型:
把图2中的物质补充到图1中,可得到一个完整的氧化还原型离子方程式(未配平):
 ……
……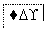
图1
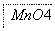
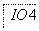

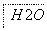
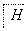
图2
对于该离子方程式的说法不正确的是 ( )。
A.IO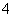 作氧化剂
作氧化剂
B.氧化性:Mn2+>IO
C.氧化剂与还原剂的物质的量之比为5∶2
D.若有2 mol Mn2+参加反应时,则转移10 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
高铁酸钠(Na2FeO4)是一种新型消毒剂,工业上制备高铁酸钠有下列四种方法:
a.2Fe(OH)3+3NaClO+4NaOH===2Na2FeO4+3NaCl+5H2O;
b.2FeSO4+6Na2O2===2Na2FeO4+2Na2O+2Na2SO4+O2↑;
c.Fe2O3+3Na2O2===2Na2FeO4+Na2O;
d.Fe(NO3)3+NaOH+Cl2―→Na2FeO4+NaNO3+NaCl+H2O。
请回答下列问题:
(1)下列判断正确的是________(填序号)。
A.方法a、b、c都可在水溶液中进行
B.根据a、b可知NaClO、Na2O2的氧化性均强于Na2FeO4的
C.FeSO4只有还原性,没有氧化性
D.能用KSCN溶液检验b的产物中是否含有FeSO4
(2)对于方法c下列说法正确的是________(填序号)。
A.Na2O2既是氧化剂又是还原剂
B.还原产物只有Na2O
C.3 mol Na2O2发生反应,有6 mol电子转移
D.在Na2FeO4中Fe为+4价,具有强氧化性,能消毒杀菌
(3)对于方法d,请回答下列问题:
①氧化剂与还原剂的物质的量之比为________。
②写出Na2FeO4与H2O反应的离子方程式:____________________________,
请你推测Na2FeO4除了能消毒杀菌外,另一个用途是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
Mn、Fe均为第四周期过渡元素,两元素的部分电离能(I)数据列于下表:
| 元 素 | Mn | Fe | |
| 电离能 (kJ·mol-1) | I1 | 717 | 759 |
| I2 | 1 509 | 1 561 | |
| I3 | 3 248 | 2 957 |
回答下列问题:
(1)Mn元素价电子层的电子排布式为____________,比较两元素的I2、I3可
知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难。对此,你的
解释是___________________________________________________________。
(2)Fe原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成
配合物,则与Fe原子或离子形成配合物的分子或离子应具备的条件是
__________________________。
(3)三氯化铁常温下为固体,熔点282 ℃,沸点315 ℃,在300 ℃以上易升华。
易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断三氯化铁晶体为
____________晶体。
(4)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如下图所示。面心
立方晶胞和体心立方晶胞中实际含有的Fe原子个数之比为________。
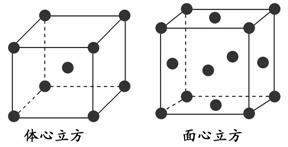
查看答案和解析>>
科目:高中化学 来源: 题型:
有关天然产物水解的叙述不正确的是( )
A.油脂水解可得到丙三醇
B.可用碘检验淀粉水解是否完全
C.蛋白质水解的最终产物均为氨基酸
D.纤维素水解与淀粉水解得到的最终产物不同
查看答案和解析>>
科目:高中化学 来源: 题型:
科学家发现某药物M能治疗心血管疾病是因为它在人体内能释放出一种“信使分子”D,并阐明了D在人体内的作用原理。
请回答下列问题:
(1)已知M的相对分子质量为227,由C、H、O、N四种元素组成,C、H、N的质量分数依次为15.86%、2.20%和18.50%,则M的分子式是____________。D是双原子分子,相对分子质量为30,则D的分子式是______________________________。
(2)油脂A经如图所示的途径可得到M。

图中②的提示为:

反应①的化学方程式是
________________________________________________________________________;
反应②的化学方程式是
(3)C是B和乙酸在一定条件下反应生成的化合物,相对分子质量为134,写出C所有可能的结构简式: ________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
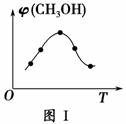
火力发电厂释放出大量二氧化碳,对燃煤废气进行脱碳等处理,可实现绿色环保、节能减排、废物利用等目的。将CO2转化为甲醇是一种新型脱碳技术,其反应为CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH。
(1)取五份等体积的CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如图Ⅰ所示,则上述CO2转化为甲醇的反应的ΔH________0(填“>”、“<”或“=”)。

(2)如图Ⅱ是在恒温密闭容器中,压强为p1时H2的体积分数随时间t的变化曲线,请在图中画出该反应在p2(p2>p1)时H2的 体积分数随时间t的变化曲线。
(3)在一恒温恒容密闭容器中充入1 mol CO2和3 mol H2,进行上述反应。测得CO2和CH3OH(g)的物质的量浓度随时间的变化如图Ⅲ所示。

则0~10 min内,氢气的平均反应速率为________;该温度下,反应的平衡常数为________(保留三位有效数字);10 min后,向该容器中再充入1 mol CO2和3 mol H2,则再次达到平衡时CH3OH(g)的体积分数________(填“增大”、“减小”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com