
 ��֪������G�ĺϳ�·�����£�
��֪������G�ĺϳ�·�����£�
��1����Ӧ��ķ�Ӧ����Ϊ_____________����Ӧ���ķ�Ӧ����Ϊ ��
��2��д����Ӧ��Ļ�ѧ����ʽ_____________________��
д����Ӧ��Ļ�ѧ����ʽ_____________________��
��3����֪��˶���Ӧ�� 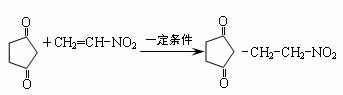 ����Ӧ�����������г�����˶���Ӧ���ͣ���F�ĺ˴Ź����������������շ壬�����Ϊ3:1����F�Ľṹ��ʽΪ ��
����Ӧ�����������г�����˶���Ӧ���ͣ���F�ĺ˴Ź����������������շ壬�����Ϊ3:1����F�Ľṹ��ʽΪ ��
��4��д������C�����й����ŵķ���������____________________________________��
��5����G��2����ԭ�ӵ����ʾ����������ʣ�
����FeCl3��Һ����ɫ�� �ڱ����ϵ�һ��ȡ����ֻ��һ�֣�
��1mol������������1mol NaOH�� �ܲ�������ԭ��������һ��������
���ϸ�Ҫ����л�����_______�֣���д���ָ����ʵĽṹ��ʽ ��
��1��ȡ����Ӧ(1��) �ӳɷ�Ӧ (1��)
��2��CH2= CH CH2Cl+NaOH ˮ��CH2= CH CH2OH+NaCl��2�֣�
2 CH2= CH CH2OH+ O2 Cu�� 2CH2=CHCHO+2H2O��2�֣�
��3�� CH3COCH2COCH3��2�֣�
��4��ȡ������ϩȩ��C�����Թ������������Ƶ�������Һ��ˮԡ���ȣ������Ƶ�������ͭ��ֱ�Ӽ��ȣ������γɹ������������������ɫ��������֤����ȩ����ȡ������Ӧ�����Һ�������������ữ���뼸����ˮ���������أ�����ɫ��֤����̼̼˫������3�֣�
��5��8��2�֣���

 ��2�֣�
��2�֣�


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ij�л����������2,2,3,3-�ļ����飬�����й���ṹ��ʽ����д��ȷ����
A��(CH3)3CCH(CH3)2 B��(CH3)3CCH2C(CH3)2
C��(CH3)3CC(CH3)2CH2CH3 D��(CH3)3CC(CH3)3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��1����(N2H4)�ֳ��������ڳ�������һ�ֿ�ȼ�Ե�Һ�壬���������ȼ�ϡ���֪��101kPaʱ��1gN2H4����������ȫȼ�����ɵ�����H2O���ų�19.5kJ����(25��ʱ)����ʾN2H4ȼ���ȵ��Ȼ�ѧ����ʽ��____________________________________________________��
��2���£�����ȼ�ϵ����һ�ּ���ȼ�ϵ�أ��������Һ��20%��30%��KOH��Һ���£�����ȼ�ϵ�طŵ�ʱ��
�����ĵ缫��Ӧʽ��__________________________��
�����ĵ缫��Ӧʽ��__________________________��
��3����ͼ��һ��������ʾ��ͼ��

��пƬ�Ϸ����ĵ缫��Ӧʽ�ǣ�_____________________________��
�ڼ���ʹ���£�����ȼ�ϵ����Ϊ�ù����еĵ�Դ��ͭƬ�����仯Ϊ128g�����£�����ȼ�ϵ�����������ı�״���µĿ���________L(��������������������Ϊ20%)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
A��B��CΪ���ֶ�����Ԫ�أ�A��B��ͬ���ڣ�A��C����ͼ����ӷֱ�ΪA2����
C����B2����C��������ͬ�ĵ��Ӳ�ṹ������˵���У���ȷ����
A��ԭ��������A��B��C B��ԭ�Ӱ뾶��A��B��C
C�����Ӱ뾶��A2����B2����C�� D��ԭ��������������A��C��B
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���������ҹ���������̼���о����ش��չ���绡���ϳɵ�̼���ܣ������д������ʡ���̼������������̼���������������������ᴿ���䷴Ӧ�Ļ�ѧ����ʽΪ:
C+ K2Cr2O7 + H2SO4(ϡ) CO2��+ Cr2 (SO4) 3+ + .
CO2��+ Cr2 (SO4) 3+ + .
��1���˷�Ӧ���������� ����������Ԫ���� ��
��2����ɲ���ƽ������Ӧ�Ļ�ѧ����ʽ��
��3��H2SO4��������Ӧ�б��ֳ����������� ����ѡ���ţ�
A������ B�������� C����ˮ�� D����ˮ��
��4������0.5mol��ԭ����ʱ��ת�Ƶĵ��ӵ����ʵ���Ϊ mol��
��5��K2Cr2O7�����ڲⶨ�����εĺ���������FeSO4����0.4000�ˣ��ܽ��ữ����Ũ��Ϊ0.02000mol/L��K2Cr2O7����Һ�ζ������ı���Һ20.00mL�����������FeSO4����������Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
NA��ʾ�����ӵ�������ֵ�����������в���ȷ���ǣ� ��
A.1mol��ϩ���Ҵ��Ļ�����������г��ȼ�գ����������ķ�����Ϊһ��Ϊ3NA
B.28g��ϩ�ͻ����飨C4H8���Ļ�������к��е�̼ԭ����Ϊ2NA
C.���³�ѹ�£�92g��NO2��N2O4������庬�е�ԭ����Ϊ6NA
D.���³�ѹ�£�22.4L����������þ�۳�ַ�Ӧ��ת�Ƶĵ�����Ϊ2 NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
Ҫ����ϩ���Ƿ���������ױ�����ȷ��ʵ�鷽����( )
A���ȼ����������Ը��������Һ��Ȼ���ټ�����ˮ
B���ȼ�������ˮ��Ȼ���ټ������Ը��������Һ
C���ֱ��ȼ������Һ�壬�۲�����
D������Ũ������Ũ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���й�ϵ�У���ȷ����
A��ԭ�Ӱ뾶��Mg��K B���ǽ����ԣ�O��S
C���ȶ��ԣ�HCl��HBr D�����ԣ�NaOH��KOH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�������ִ������а�����Խ��Խ��Ҫ�Ľ�ɫ������β����̼�⻯����������Pһ����̼�ȣ������Ļ�����ȾԽ��Խ���ԣ������������ŷ��ѳ�Ϊ���д�����Ⱦ����Ҫ��Դ��
��1�������ͳɷ�ΪC8H18�������������������ѽ��������Ͷ�ϩ��д���÷�Ӧ�Ļ�ѧ����
�� ��
��2������������NO�ķ�ӦΪ��N2(g)+O2(g)  2NO(g) ��H ��0
2NO(g) ��H ��0
�������������������¶�Խ�ߣ���λʱ����NO�ŷ���Խ��ԭ���� �� ��
��1mol�����к���0.8molN2��0.2molO2��1300��ʱ�ں�1mol�������ܱ������ڷ�Ӧ�ﵽƽ�⡣���NOΪ8��10��4mol��������¶��µ�ƽ�ⳣ��K�� �� ��
��3��β���е�CO��Ҫ���������Ͳ���ȫȼ�ա�
���������밴���з�Ӧ��ȥCO��2CO(g)=2C(s)+O2(g) ��H=+221kJ��mol��1, �����������ܷ�ʵ�ֵ����ݣ� �� ��
�ڲ�������β����Ũ�ȳ��õ绯ѧ����������������CO������������ͼ��ʾ�������������ĵ缫��ӦΪ �� ��

��4��������β��ϵͳ�а�װ��ת����������Ч����β���е�CO��NOx ��̼�⻯����ȷ�����
��֪��N2(g)��O2(g)=2NO(g) ��H1=��180kJ/mol
CO(g) ��1/2O2(g)= CO2(g) ��H2=��283kJ/mol
2NO(g)�� 2CO(g) = 2CO2(g) �� N2(g) ��H3
���H3 = �� kJ��mol��1��
��5���⻯ѧ��������������ȩ�ࡢ���������������ȣ�������β���������������·����⻯ѧ��Ӧ���ɵĶ�����Ⱦ�д��2����ϩ����������ʵ���֮��Ϊ1��2��Ӧ������ȩ�������Ļ�ѧ����ʽ �� ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com