
| A. | 烧杯中的溶液没有恢复到室温就转移到容量瓶,一定会导致结果偏高 | |
| B. | 没有洗涤烧杯和玻璃棒,一定会导致结果偏低 | |
| C. | 容量瓶使用时没有干燥会导致结果偏低 | |
| D. | 使用量筒量取浓溶液后,没有把洗涤量筒得到洗涤液转移到容量瓶,会导致结果偏低 |
分析 分析操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$进行误差分析,凡是使物质的量n偏大,或者使溶液体积V偏小的操作都会使溶液浓度偏大,反正使溶液浓度偏低,据此解答.
解答 解:A.烧杯中的溶液没有恢复到室温就转移到容量瓶,烧杯内液体温度若低于容量瓶标定温度,则溶液体积偏大,溶液浓度偏低,若烧杯内液体温度高于容量瓶标定温度,则溶液体积偏小,溶液浓度偏高,故A错误;
B.没有洗涤烧杯和玻璃棒,导致部分溶质损耗,溶质的物质的量偏小,溶液浓度一定会偏低,故B正确;
C.容量瓶使用时没有干燥,对溶质的物质的量和溶液体积都不会产生影响,溶液浓度不受影响,故C错误;
D.使用量筒量取浓溶液后,没有把洗涤量筒得到洗涤液转移到容量瓶,操作正确,溶液浓度准确,故D错误;
故选:B.
点评 本题考查了一定物质的量浓度溶液配制的误差分析,明确配制原理依据据C=$\frac{n}{V}$进行分析即可解答,题目难度不大.


 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 12g金刚石中含有C-C键4NA | |
| B. | 基态氧原子的电子排布图: | |
| C. | H2SO4、H3PO4、HClO4的酸性依次减弱 | |
| D. |  的沸点比 的沸点比 的沸点高 的沸点高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
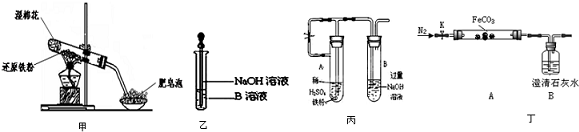
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
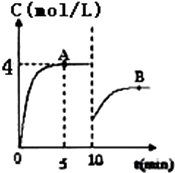 在一定条件下,合成塔中氮气和氢气的起始浓度分别为a mol•L-1和b mol•L-1,反应为:N2+3H2?2NH3,氨气的浓度随时间变化如图所示.
在一定条件下,合成塔中氮气和氢气的起始浓度分别为a mol•L-1和b mol•L-1,反应为:N2+3H2?2NH3,氨气的浓度随时间变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 2Fe3++SO2+2H2O═2Fe2++SO42ˉ+4H+ | B. | Cl2+SO2+2H2O═H2SO4+2HCl | ||
| C. | 2 Fe3++2Cl-═2 Fe2++Cl2↑ | D. | 2 Fe2++I2═2 Fe3++2I- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、NO3-、CO32-、Na+ | B. | Na+、Ba2+、Mg2+、HCO3- | ||
| C. | NO3-、Ca2+、K+、Cl- | D. | NO3-、K+、ClO-、Ca2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | IBr跟水的反应是非氧化还原反应 | |
| B. | 在很多反应中,IBr是强氧化剂 | |
| C. | IBr是共价化合物 | |
| D. | IBr跟NaOH稀溶液反应生成NaI、NaBrO和H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 焰色反应为化学变化 | |
| B. | 用完的铂丝用稀硫酸清洗 | |
| C. | 可用焰色反应区别NaCl和KCl溶液 | |
| D. | 焰色反应为黄色,样品一定不含钾元素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com