
| A. | 常温下,0.1 mol•L-1 NH4Cl溶液的pH=1 | |
| B. | 工业上电解饱和食盐水时,以石墨为阴极,铁棒为阳极 | |
| C. | 反应CO2(g)+C(s)═2CO(g)在高温下可自发进行,则该反应的△H>0 | |
| D. | 常温下,在AgCl悬浊液中加入少量NaCl饱和溶液,[Ag+]减小,Ksp(AgCl)减小 |
分析 A.0.1 mol•L-1 NH4Cl溶液水解显酸性,且氢离子浓度小于0.1mol/L;
B.电解饱和食盐水时,阳极应为惰性电极;
C.△H-T△S<0的反应可自发进行;
D.加入少量NaCl饱和溶液,氯离子浓度增大,抑制AgCl的溶解,但Ksp只与温度有关.
解答 解:A.0.1 mol•L-1 NH4Cl溶液水解显酸性,且氢离子浓度小于0.1mol/L,则常温下,0.1 mol•L-1 NH4Cl溶液的pH>1,故A错误;
B.电解饱和食盐水时,阳极应为惰性电极,则石墨为阳极,铁为阴极,故B错误;
C.△H-T△S<0的反应可自发进行,则CO2(g)+C(s)═2CO(g)的△S>0,则高温下可自发进行,则该反应的△H>0,故C正确;
D.加入少量NaCl饱和溶液,氯离子浓度增大,抑制AgCl的溶解,但Ksp只与温度有关,则[Ag+]减小,Ksp(AgCl)不变,故D错误;
故选C.
点评 本题考查难溶电解质的溶解平衡,为高频考点,把握盐类水解、电极、反应进行方向、溶解平衡为解答的关键,侧重分析与应用能力的考查,综合性较强,题目难度不大.


科目:高中化学 来源: 题型:实验题
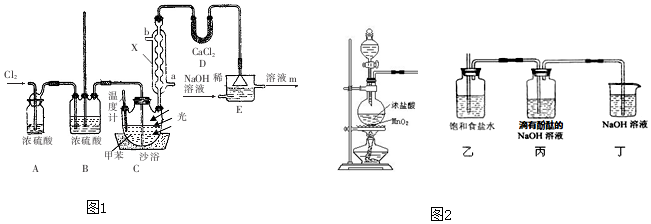
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaBH4与盐酸不反应 | |
| B. | NaBH4的电子式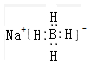 | |
| C. | 每生成1molFe,转移2mol电子 | |
| D. | 氧化产物与还原产物的物质的量之比为1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 加热稀盐酸和MnO2的混合物 | |
| B. | 在KMnO4中加入NaCl和浓H2SO4并加热 | |
| C. | KCl加硫酸并加KClO2再加热 | |
| D. | 浓盐酸中加入浓H2SO4并加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 从海水中可提取镁,电解熔融氯化镁可制得金属镁 | |
| B. | 应用高纯度单质硅制成光导纤维,提高信息传输速度 | |
| C. | 研制高性能的耐磨轮胎,可减少PM2.5等细颗粒物的产生 | |
| D. | 开发二氧化碳制成的全降解塑料,缓解日益严重的“白色污染” |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2+、NO3-、K+、Cl- | B. | K+、Al3+、HCO3-、Cl- | ||
| C. | H+、Ca2+、HCO3-、Cl- | D. | Ca2+、HCO3-、OH-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
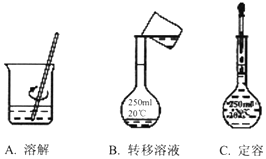 实验室需要配制250mL 1.6mol•L-1的NaOH溶液,请回答下列问题:
实验室需要配制250mL 1.6mol•L-1的NaOH溶液,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.
如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2L的甲醇所含的氢原子数等于2NA | |
| B. | 常温常压下,Na2O2 与 H2O 反应生成 1mol O2 时,转移电子数是 2NA | |
| C. | 25℃时,Kap(BaSO4)=1×10-10,则BaSO4饱和溶液中Ba2+数目为1×10-6 NA | |
| D. | 1L 1 mol/L AlCl3溶液中含有的Al3+数目为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com