
【题目】健康人体内含铁元素大约 2~3g,人体内铁元素以亚铁离子和三价铁离子的形式存在,Fe2+易被吸收,所以给贫血者补充铁元素时,应补充含 Fe2+的亚铁盐。“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种常见的补铁药物。该药品不溶于水但能溶于人体中的胃酸。某同学为了检测“速力菲”药片中Fe2+的存在,设计并进行了如下实验:

(1) 试剂1的名称是__________;试剂2的化学式为______________。
(2) 加入新制氯水,溶液中发生反应的离子方程式是_____________________________。
(3) 加入试剂2 时溶液为淡红色说明 “速力菲”中的 Fe2+已部分氧化,一般在服用“速力菲”时,同时服用维生素C,说明维生素C具有___________性。
(4) 不仅溶液中Fe2+易被氧化成Fe3+,溶液中白色沉淀Fe(OH)2更易被O2氧化,请写出反应的化学方程式________________________,现象为__________________________。
【答案】盐酸 KSCN 2Fe2+ + Cl2 == 2Fe3+ + 2Cl- 还原性 4Fe(OH)2 + O2 + 2H2O == 4Fe(OH)3 白色沉淀迅速变为灰绿色,最终变为红褐色
【解析】
(1)根据“琥珀酸亚铁不溶于水但能溶于人体中的胃酸”分析,应用盐酸溶解琥珀酸亚铁;淡黄色溶液加入试剂2变为淡红色,加入新制氯水后溶液变血红色,则加入的试剂2是KSCN;
(2)加入新制氯水后溶液变为血红色,说明Fe2+被氧化为Fe3+;
(3)Vc可使食物中的Fe3+转化成Fe2+,Fe元素的化合价降低,所以Fe3+是氧化剂,Vc是还原剂,则Vc具有还原性;
(4)碱性环境中Fe(OH)2被O2氧化为氢氧化铁;现象为白色沉淀迅速变为灰绿色,最终变为红褐色。
(1)根据“琥珀酸亚铁不溶于水但能溶于人体中的胃酸”,用盐酸溶解琥珀酸亚铁,所以试剂1是盐酸;淡黄色溶液加入试剂2变为淡红色,加入新制氯水后溶液变血红色,则加入的试剂2是KSCN溶液;
故答案为:盐酸;KSCN;
(2)加入新制氯水后溶液变为血红色,说明Fe2+被氧化为Fe3+,溶液中发生反应的离子方程式是2Fe2+ + Cl2 == 2Fe3+ + 2Cl-;
故答案为:2Fe2+ + Cl2 == 2Fe3+ + 2Cl-;
(3)Vc可使食物中的Fe3+转化成Fe2+,Fe元素的化合价降低,所以Fe3+是氧化剂,Vc是还原剂,则Vc具有还原性;
故答案为:还原性;
(4)碱性环境中Fe(OH)2被O2氧化为氢氧化铁,反应方程式为4Fe(OH)2 + O2 + 2H2O == 4Fe(OH)3;现象为白色沉淀迅速变为灰绿色,最终变为红褐色;
故答案为:4Fe(OH)2 + O2 + 2H2O == 4Fe(OH)3;白色沉淀迅速变为灰绿色,最终变为红褐色。


 快乐5加2金卷系列答案
快乐5加2金卷系列答案科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:
①2H2(g)+O2(g)=2H2O(l)ΔH=﹣570 kJ![]()
②2H2O(g)=2H2(g)+O2(g)ΔH=+483.6kJ![]()
③2C(s)+O2(g)=2CO(g)ΔH=﹣220.8 kJ![]()
④C(s)+O2(g)=CO2(g)ΔH=﹣393.5 kJ![]()
回答下列问题:
(1)上述反应中属于吸热反应的是_______(填写序号)。
(2)H2的燃烧热为________。
(3)燃烧10 g H2生成液态水,放出的热量为________。
(4)CO的燃烧热的热化学方程式为______________________。
(5)H2O(l)=H2O(g)ΔH=__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明矾[KA1(SO4)2·12H2O]是一种复盐,在造纸等方面应用广泛。采用废易拉罐制备明矾的过程如下图所示。
下列叙述错误的是
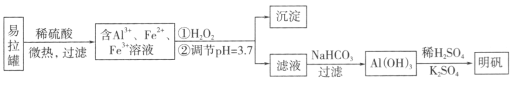
A. 合理处理易拉罐有利于环境保护和资源再利用
B. 从易拉罐中可回收的金属元素有Al、Fe
C. “沉淀”反应的金属离子为Fe3+
D. 上述流程中可用NaHSO4代替NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现用质量分数为98%、密度为1.84 g·cm-3的浓硫酸来配制480 mL 0.5 mol·L-1的稀硫酸。可供选择的仪器如下图
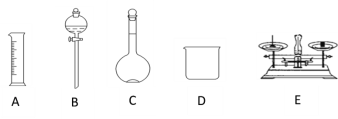
请回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是___________(填序号),配制上述溶液还需用到的玻璃仪器是_______________(填仪器名称)。
(2)使用容量瓶之前必须进行的操作是______________________________。
(3)经计算,需浓硫酸的体积为_____mL(小数点后保留 1位小数)。现有 ①10 mL
②50 mL ③100 mL三种规格的量筒,你选用的量筒是____(填序号)。
(4)配制溶液时,一般可分为以下几个步骤:
①量取 ②计算 ③稀释 ④摇匀 ⑤转移 ⑥洗涤 ⑦定容 其正确的操作顺序为:②→①→③→_________(填序号)。
(5)在配制过程中,其他操作都准确,下列操作使所配溶液浓度偏高的是_______ (填序号)
①洗涤量取浓硫酸的量筒,并将洗涤液转移到容量瓶中
②稀释后的硫酸溶液未等冷却至室温就转移到容量瓶中
③转移前,容量瓶中含有少量蒸馏水
④定容摇匀后,发现液面低于刻度线,又用胶头滴管加蒸馏水至刻度线
⑤定容时俯视刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可用固体二氧化锰与浓盐酸在加热条件下制取氯气,化学方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,已知浓盐酸易挥发。某学生设计如下图所示的实验装置,利用氯气与潮湿的熟石灰反应制取少量漂白粉(这是一个放热反应)。回答下列问题:
MnCl2+Cl2↑+2H2O,已知浓盐酸易挥发。某学生设计如下图所示的实验装置,利用氯气与潮湿的熟石灰反应制取少量漂白粉(这是一个放热反应)。回答下列问题:
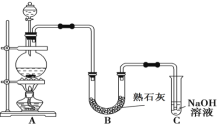
(1)A装置为实验室制取氯气的装置,A装置中反应的离子方程式为__________________。
(2)漂白粉将在U形管中产生,其化学方程式是___________________________________。
(3)C装置的作用是____________________。
(4)此实验所得漂白粉的有效成分偏低,该学生经分析并查阅资料发现,主要原因是在U形管中还存在两个副反应。
①温度较高时氯气与熟石灰反应生成Ca(ClO3)2,为避免此副反应的发生,可采取的措施是____________________。
②试判断另一个副反应_____________________________________(用化学方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应:2A(气) + 3B(气) ![]() 3C(气),一定条件下,在一密闭、恒容的容器中,使一定量A和B气体反应,下列叙述能用来判断达到平衡状态的是:
3C(气),一定条件下,在一密闭、恒容的容器中,使一定量A和B气体反应,下列叙述能用来判断达到平衡状态的是:
A.各物质的浓度之比为c(A):c(B):c(C) = 2:3:3
B.气体的总体积是反应开始时的 3/5
C.混合气体的密度不变
D.单位时间内, 若消耗了 a mol A 物质, 同时也消耗了 1.5 a mol 的C物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KI广泛应用于分析试剂、感光材料、制药和食品添加剂等。实验室制备KI的装置如下图所示。
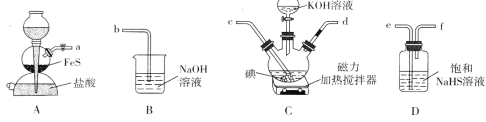
已知:①3I2+6KOH![]() 5KI+KIO3+3H2O②3H2S+KIO3
5KI+KIO3+3H2O②3H2S+KIO3![]() KI+3S↓+3H2O
KI+3S↓+3H2O
(1)利用上图装置制备KI,其连接顺序为_____________(按气流方向,用小写字母表示)。
(2)检查装置A气密性的方法是____________;装置D的作用是____________________。
(3)制备KI时,向三颈瓶中逐滴滴入KOH溶液,加热并不断搅拌,观察到棕黄色溶液变为无色时,立即停止滴加KOH溶液,然后通入足量H2S气体。
①反应结束后,向三颈瓶中加入硫酸溶液并加热,可以除去KI溶液中的H2S,原因是________________________________________。
②用肼(N2H4)替代H2S,制得产品纯度更高,理由是_______________(用化学方程式表示)。
(4)设计实验方案除去KI溶液中的稀硫酸_____________________________。
(5)若得到1.6g硫单质,理论上制得KI的质量为_________________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在药物制剂中,抗氧剂与被保护的药物在与O2发生反应时具有竞争性,抗氧性强弱主要取决于其氧化反应的速率。Na2SO3、NaHSO3和Na2S2O5是三种常用的抗氧剂。
已知:Na2S2O5 溶于水发生反应:S2O52+H2O=2HSO3
实验用品 | 实验操作和现象 |
①1.00×10-2mol/L Na2SO3溶液 ②1.00×10-2mol/L NaHSO3溶液 ③5.00×10-3mol/L Na2S2O5溶液 | 实验1:溶液①使紫色石蕊溶液变蓝,溶液②使之变红。 实验2:溶液①与O2反应,保持体系中O2浓度不变,不同pH条件下,c(SO32) 随反应时间变化如下图所示。 实验3:调溶液①②③的pH相同,保持体系中O2浓度不变,测得三者与O2的反应速率相同。 |
下列说法中,不正确的是

A. Na2SO3溶液显碱性,原因是:SO32+H2O![]() HSO3+OH
HSO3+OH
B. NaHSO3溶液中HSO3的电离程度大于水解程度
C. 实验2说明,Na2SO3在pH=4.0时抗氧性最强
D. 实验3中,三种溶液在pH相同时起抗氧作用的微粒种类和浓度相同,因此反应速率相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成气(CO和H2)是目前化工常用的原料,下面是用甲烷制备合成气的两种方法:
① CH4(g)+H2O(g)![]() CO(g)+3H2(g) ΔH1=+216 kJ·mol-1;
CO(g)+3H2(g) ΔH1=+216 kJ·mol-1;
② 2CH4(g)+O2(g) ![]() 2CO(g)+4H2(g) ΔH2=-72 kJ·mol-1。
2CO(g)+4H2(g) ΔH2=-72 kJ·mol-1。
其中一个反应的反应过程与能量变化关系如图所示。则下列说法正确的是( )
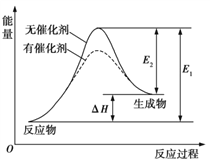
A. E1表示2CH4(g)+O2(g) ![]() 2CO(g)+4H2(g)的活化能
2CO(g)+4H2(g)的活化能
B. E2表示CH4(g)+H2O(g)![]() CO(g)+3H2(g)的活化能
CO(g)+3H2(g)的活化能
C. 该图示为反应②的反应过程与能量变化示意图
D. 一般情况下,加入催化剂,既能降低E1,也能降低E2,但不能改变E1与E2的差值
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com