
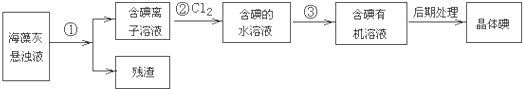


科目:高中化学 来源: 题型:
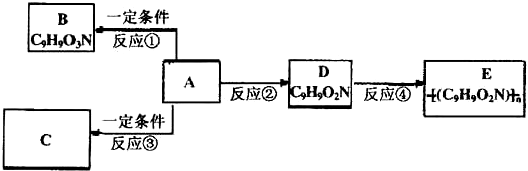
| 反应 | 反应类型 | 反应条件 |
| ② | ||
| A→B |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 0 | 20 | 40 | 60 | 80 | |
| c(N2O4)mol?L-1 | 0.100 | a | 0.050 | c | d |
| c(NO2)/mol?L-1 | 0.000 | 0.060 | b | 0.120 | 0.120 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
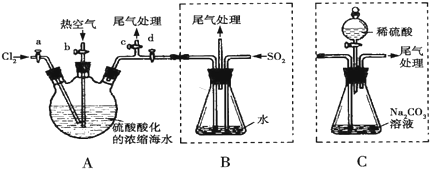
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(K+) |
| c(S2-) |
| A、②④ | B、①②⑤ |
| C、③④⑤ | D、②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氢气在空气中燃烧 |
| B、盐酸与氢氧化钠中和反应 |
| C、Ba(OH)2?8H2O与NH4Cl固体混合反应 |
| D、金属Zn与盐酸反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分子运动速率加快,使该反应物分子的碰撞机会增多 |
| B、反应物分子的能量增加,活化分子百分数增大,有效碰撞次数增多 |
| C、该化学反应的过程是吸热的 |
| D、该化学反应的过程是放热的 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com