
| A、强电解质溶液的导电性不一定比弱电解质溶液的导电性强 |
| B、常温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4 |
| C、若测得雨水的pH小于7,则下的是酸雨 |
| D、在通风橱中进行有毒气体实验符合“绿色化学”思想 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、50 mL 1 mol/L醋酸溶液 |
| B、100 mL 0.5 mol/L硫酸溶液 |
| C、100 mL 0.25 mol/L硫酸溶液 |
| D、200 mL 1 mol/L硝酸溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、
| ||||
| B、CO2和CO属于同素异形体,所以性质不同 | ||||
| C、明矾和漂白粉常用于自来水的净化和杀菌消毒,两者的作用原理相同 | ||||
| D、C(石墨,s)=C(金刚石,s);△H>0.所以石墨比金刚石稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、醋酸溶液的导电性比盐酸弱 |
| B、向醋酸钠溶液中通入少量氯化氢,c(CH3COO-)减小 |
| C、0.1 mol/L的醋酸溶液的pH约为3 |
| D、pH=1的醋酸溶液用水稀释1000倍后,pH<4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Q1+Q2<Q3 |
| B、Q1+Q2>2Q3 |
| C、2Q1+Q2>2Q3 |
| D、2Q1+Q2<2Q3 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
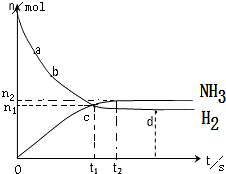 合成氨工业对国民经济和社会发展具有重要的意义.一定温度下,在2L的密闭容器中加入一定量的N2和H2,发生合成氨反应,其中n(NH3)和n(H2)随时间变化的关系如图所示.
合成氨工业对国民经济和社会发展具有重要的意义.一定温度下,在2L的密闭容器中加入一定量的N2和H2,发生合成氨反应,其中n(NH3)和n(H2)随时间变化的关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、某温度时,化学反应速率无论用A、B、C何种物质表示,其数值是相同的 |
| B、其他条件不变,增大压强,反应速率加快 |
| C、若增加或减小B的物质的量,则反应速率一定会发生明显的变化 |
| D、其他条件不变,升高温度,反应速率加快 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com