
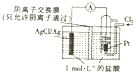
| A. | 正极反应式为Ag-e-=Ag+ | |
| B. | 放电时,溶液中的Cl-向负极移动 | |
| C. | 通入Cl2的一极为负极 | |
| D. | 当电路中转移0.01mole-时,消耗Ag的质量为2.16g |
分析 根据电池总反应为2Ag+Cl2═2AgCl可知,Ag失电子作负极失电子,氯气在正极上得电子生成氯离子,
A、正极上氯气得电子;
B、放电时,阴离子移向负极;
C、根据电池总反应,氯气在正极上得电子生成氯离子;
D、放电时,根据负极极反应式为Ag-e-=Ag+计算.
解答 解:根据电池总反应为2Ag+Cl2═2AgCl可知,Ag失电子作负极失电子,氯气在正极上得电子生成氯离子,
A、正极上氯气得电子生成氯离子,其电极反应为:Cl2+2e-═2Cl-,故A错误;
B、放电时,阴离子移向负极,所以溶液中的Cl-向负极移动,故B正确;
C、根据电池总反应为2Ag+Cl2═2AgCl可知,氯气在正极上得电子生成氯离子,故C错误;
D、放电时,当电路中转移0.01mol e-时,会有0.01molAg失去0.01mol电子生成银离子,则消耗Ag的质量为0.01=108=1.08g,故D错误.
故选:B.
点评 本题考查了原电池原理的应用及沉淀反应,注意把握原电池原理及正负极的判断和电极方程式的书写,利用电子及电荷守恒来解决原电池中有关计算的问题,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
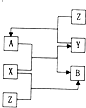 X、Y、Z为三种常见单质,Z为绿色植物光合作用后的产物之一,A、B为常见的化合物.它们在一定条件下可以发生如图所示的转化关系(反应均不是在溶液中进行的,反应条件已略去)(以下每空中填入一种即可)
X、Y、Z为三种常见单质,Z为绿色植物光合作用后的产物之一,A、B为常见的化合物.它们在一定条件下可以发生如图所示的转化关系(反应均不是在溶液中进行的,反应条件已略去)(以下每空中填入一种即可)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应起始时,两容器中生成N2O4的速率关系是v(A)=v(B) | |
| B. | 反应达到平衡前,两容器中生成N2O4的速率关系是v(A)<v(B) | |
| C. | 反应达到平衡后,NO2的转化率大小关系是v(A)<v(B) | |
| D. | 两容器均达到平衡后,再分别充入等量的氮气,发生平衡移动的是B容器,且平衡移动后,NO2的转化率将增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
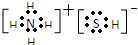 ,写出再生反应的化学方程式:2NH4HS+O2=2S↓+2NH3•H2O.NH3的沸点高于H2S,是因为NH3分子之间存在着一种比分子间作用力更强的作用力.
,写出再生反应的化学方程式:2NH4HS+O2=2S↓+2NH3•H2O.NH3的沸点高于H2S,是因为NH3分子之间存在着一种比分子间作用力更强的作用力.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
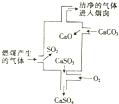
| A. | 使用此废气处理工艺不能减少SO2的排放 | |
| B. | 该过程发生的反应有化合、分解、置换和氧化还原反应 | |
| C. | 整个过程的反应可表示为2SO2+2CaCO3+O2═2CaSO4+2CO2 | |
| D. | 可用NaOH溶液检验废气处理是否达标 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
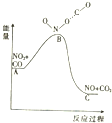
| A. | 该反应为放热反应 | |
| B. | 该反应为非氧化还原反应 | |
| C. | 1molNO2和1molCO的键能总和大于1molNO和1molCO2的键能总和 | |
| D. | 1molNO2(g)和1molCO(g)的总能量低于1mol NO(g)和1molCO2(g)的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E、F六种短周期元素的简单离子都含有10个电子,且对应元素化合价与原子序数的关系如图所示.
A、B、C、D、E、F六种短周期元素的简单离子都含有10个电子,且对应元素化合价与原子序数的关系如图所示.| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 一 | ----------------- | |||||||
| 二 | ||||||||
| 三 | ||||||||
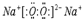 ,AB、两元素对应的气态氢化物的稳定性强弱关系是H2O>NH3(用化学式表示).
,AB、两元素对应的气态氢化物的稳定性强弱关系是H2O>NH3(用化学式表示).查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 石墨和金刚石的转化是物理变化 | |
| B. | 金刚石的稳定性强于石墨 | |
| C. | 1 mol石墨的总键能比1 mol金刚石的总键能大 1.9 kJ | |
| D. | C(s,石墨)=C(s,金刚石),该反应的焓变(△H)为负值 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 | B. | 3 | C. | 4 | D. | 5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com