
 铝生产产业链由铝土矿开采、氧化铝制取、铝的冶炼和铝材加工等环节构成.
铝生产产业链由铝土矿开采、氧化铝制取、铝的冶炼和铝材加工等环节构成.

 全能测控一本好卷系列答案
全能测控一本好卷系列答案科目:高中化学 来源: 题型:
| A、将铜屑加入含Fe3+溶液中:Fe3++Cu═Fe2++Cu2+ |
| B、NaOH溶液与氧化铝反应:Al2O3+2OH-═2AlO2-+H2O |
| C、NaHCO3溶液中加入氢氧化钠溶液:HCO3-+OH-═CO2↑+H2O |
| D、向Fe(OH)2中加入足量稀硝酸:Fe(OH)2+2H+═Fe2++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HCO3-+OH-→H2O+CO32- |
| B、2 HCO3-+Ba(OH)2→BaCO3↓+2H2O+CO32 |
| C、HCO3-+Ba2++OH-→BaCO3↓+H2O |
| D、2 HCO3-+Ba2++2OH-→BaCO3↓+2H2O+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
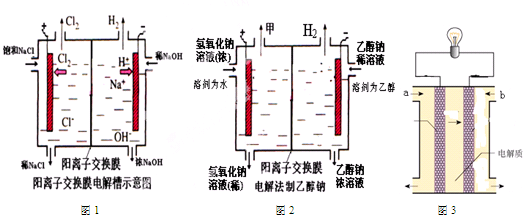
查看答案和解析>>
科目:高中化学 来源: 题型:
 在某容积不变的密闭容器中,可逆反应A(g)+B(g)?xC(g) 符合下列图中所示关系.由此推断对图II的正确说法是( )
在某容积不变的密闭容器中,可逆反应A(g)+B(g)?xC(g) 符合下列图中所示关系.由此推断对图II的正确说法是( )| A、若p3<p4,Y轴可表示B的质量分数 |
| B、若p3>p4,Y轴可表示A的转化率 |
| C、若p3>p4,Y轴可表示混合气体的平均摩尔质量 |
| D、若p3<p4,Y轴可表示混合气体的密度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | -1 | -2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2.8g |
| B、5.6g |
| C、8.4g |
| D、11.2 g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com