
 .
. 科目:高中化学 来源: 题型:实验题
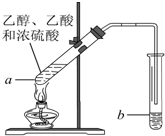 在实验室可以在试管a中加入3mL 乙醇,然后边振荡试管边慢慢加入2mL浓硫酸和2mL 乙酸,按下图所示,连接好装置进行实验,以制取乙酸乙酯.回答下列问题:
在实验室可以在试管a中加入3mL 乙醇,然后边振荡试管边慢慢加入2mL浓硫酸和2mL 乙酸,按下图所示,连接好装置进行实验,以制取乙酸乙酯.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
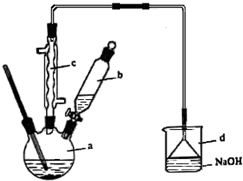 溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:| 苯 | 溴 | 溴苯 | |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
 .该反应的类型是取代反应;装置d的作用是吸收HBr和Br2;
.该反应的类型是取代反应;装置d的作用是吸收HBr和Br2;查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶解搅拌时有液体飞溅 | |
| B. | 取KMnO4样品时不慎在表面沾了点蒸馏水 | |
| C. | 定容时俯视容量瓶刻度线 | |
| D. | 定容摇匀后见液面下降,再加水至刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 16mol | B. | 6mol | C. | 12mol | D. | 4mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原溶液中一定存在SO42-、NH4+、Cl- | |
| B. | 原溶液中一定不存在Br-、Fe2+、SO32- | |
| C. | 原溶液中可能存在SO32-、K+ | |
| D. | 原溶液中滴定存在K+,c(K+)≥0.2mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 (1)实验室用如图所示装置制备少量乙酸乙酯.
(1)实验室用如图所示装置制备少量乙酸乙酯.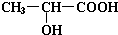 .试回答:
.试回答: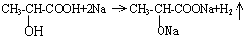 ;
;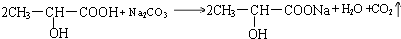 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com