
已知1 mol氢气完全燃烧生成水蒸气时放出能量242 kJ,拆开1 mol氧气中的化学键需要吸收能量496 kJ,水蒸气中1 mol H—O键形成时放出能量463 kJ。计算氢气中1 mol H—H键断裂时吸收多少能量?
科目:高中化学 来源: 题型:
某同学在用稀硫酸与锌反应制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)上述实验中发生反应的化学方程式有__________________。
(2)硫酸铜溶液可以加快氢气生成速率的原因是____________。
(3)实验室中现有Na2SO4、MgSO4、Ag2SO4、K2SO4等4种溶液,可与上述实验中CuSO4溶液起相似作用的是________。
(4)要加快上述实验中气体产生的速率,还可采取的措施有________________________________________________________(答两种)。
(5)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
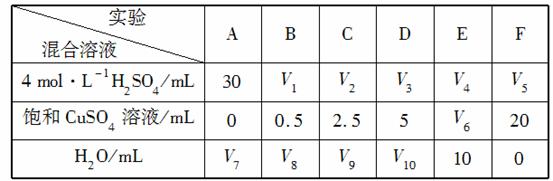
①请完成此实验设计,其中:V1=________,V6=________,V9=________;
②反应一段时间后,实验A中的金属呈________色,实验E中的金属呈________色;
③该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高,但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因:
___________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
(Ⅰ)在一定体积的密闭容器中进行如下化学反应:CO2(g)+H2(g)═CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表所示:
t/℃ 700 800 830 1000 1200
K 0.6 0.9 1.0 1.7 2.6
回答下列问题:
(1)该反应的化学平衡常数表达式为K==.
(2)该反应为反应(填“吸热”或“放热”).
(3)能判断该反应达到化学平衡状态的依据是BC.
A.容器中压强不变
B.混合气体中C(CO)不变
C.V(H2)正=V(H2O)逆
D.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:C(CO2)•C(H2)=c(CO)•c(H2O),试判断此时的温度为℃.
(Ⅱ)难溶弱电解质在水溶液中既存在溶解平衡又存在电离平衡.
已知Cu(OH)2═Cu2++2OH﹣,KSP=c(Cu2+)•2=2×l0﹣20.当溶液中各离子浓度方次的乘积大于溶度积时,则产生沉淀,反之固体溶解.
(1)某CuSO4溶液里c(Cu2+)=0.02mol•L﹣1,如要生成Cu(OH)2沉淀,应调整沉淀pH使之大于.
(2)要使0.2mol•L﹣1CuSO4溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一),则应向溶液里加入NaOH溶液,使溶液PH为.
查看答案和解析>>
科目:高中化学 来源: 题型:
如图表示某气体反应的能量变化示意图,据此分析下列判断错误的是( )
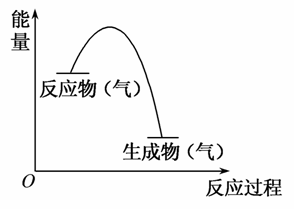
A.这是一个放热反应
B.该反应可能需要加热
C.生成物的总能量低于反应物的总能量
D.反应物比生成物更稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
白磷与氧气可发生如下反应:P4+5O2===P4O10。已知断裂下列化学键需要吸收的能量分别为:P—P a kJ·mol-1、P—O b kJ·mol-1、P===O c kJ·mol-1、O===O d kJ·mol-1。
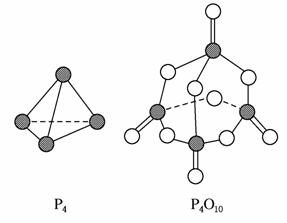
根据图示的分子结构和有关数据估算该反应的ΔH,其中正确的是( )
A.(6a+5d-4c-12b)kJ·mol-1
B.(4c+12d-6a-5d)kJ·mol-1
C.(4c+12b-4a-5d)kJ·mol-1
D.(4a+5d-4c-12b)kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:
①2C(s)+O2(g)═2CO(g)△H=﹣221.0kJ/mol
②C(s)+O2(g)═CO2(g)△H=﹣393.51kJ/mol
计算反应C(s)+CO2(g)═2CO(g)的反应热△H为( )
|
| A. | +172.51 kJ/mol | B. | ﹣283.01 kJ/mol |
|
| C. | +283.01 kJ/mol | D. | +504.00 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
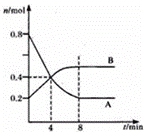
某温度时,在2L容器中,某一反应中A、B的物质的量随时间变化的曲线如图所示,由图中数据分析得:
(1)在4min末时,A、B的物质的量浓度c(A) c(B),从0~4min内A、B的物质的量浓度变化量△c(A) △c(B)(以上填“>”“<”或“=”).
(2)从反应开始至4min时,A的平均反应速率为 .
(3)该反应的化学方程式为 .
查看答案和解析>>
科目:高中化学 来源:2014-2015陕西省西安市高二上学期期末考试化学试卷(解析版) 题型:选择题
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:
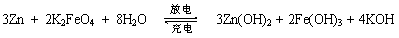
下列叙述不正确的是
A.放电时负极反应为:Zn - 2e— + 2OH— == Zn(OH)2
B.充电时阳极反应为:Fe(OH)3 -3e— + 5OH— == FeO42— + 4H2O
C.放电时每转移3moL电子,正极有1 mol K2FeO4被氧化
D.放电时正极附近溶液的碱性增强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com