
 .
. 分析 (1)A.同周期自左而右电负性增大;
B.苯分子中化学键是介于单键与双键之间的一种特殊化学键;
C.氯化钠晶体中氯离子配位数为6、氯化铯晶体中氯离子的配位数为8;
D.As原子4p能级有3个电子,处于半满稳定状态,能量降低,第一电离能高于同周期相邻元素;
(2)根据Cu的电子排布式书写Cu2+离子的电子排布式,注意原子形成离子先失去高能层中高能级电子;
NH3分子中N原子成3个N-H键,含有1对孤对电子,杂化轨道数目为4,采取sp3杂化;
Cu2+提供空轨道,N原子提供孤对电子,Cu2+与NH3分子之间形成配位键.
解答 (1)A.同周期自左而右电负性增大,故电负性F>O>N,故A正确;
B.苯分子中化学键是介于单键与双键之间的一种特殊化学键,故B错误;
C.氯化钠晶体中氯离子配位数为6、氯化铯晶体中氯离子的配位数为8,故D错误;
D.同周期自左而右等于电离能呈增大趋势,但As原子4p能级有3个电子,处于半满稳定状态,能量降低,第一电离能高于同周期相邻元素,故第一电离能Br>As>Se,故D错误;
故选:A;
(2)Cu是29号元素,原子核外电子数为29,基态原子核外电子排布式为:1s22s22p63s23p63d104s1,铜原子失去4s及3d上各一个电子形成Cu2+,故Cu2+离子的电子排布式为:1s22s22p63s23p63d9,
NH3分子中N原子成3个N-H键,含有1对孤对电子,杂化轨道数目为4,采取sp3杂化;
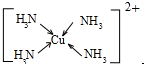
Cu2+提供空轨道,N原子提供孤对电子,Cu2+与NH3分子之间形成配位键,内界结构用示意图表示为 ,
,
故答案为:1s22s22p63s23p63d9;sp3; .
.
点评 本题综合性较大,涉及电离能、电负性、杂化轨道、配位键、核外电子排布规律等,难度中等,注意等电子体中价层电子数相同的微粒具有相似的结构.


科目:高中化学 来源: 题型:选择题
| 选项 | A | B | C | D |
| 实验方案 | 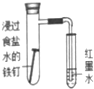 | 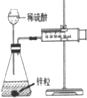 | 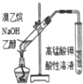 | 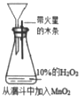 |
| 现象 | 导管中有红色柱 | 注射器的活塞往外推 | 高锰酸钾酸性溶液褪色 | 带火星的木条复燃 |
| 结论或作用 | 证明铁钉发生吸氧腐蚀 | 可用于测定反应物浓度对反应速率的影响 | 溴乙烷与NaOH乙醇溶液反应生成的气体是乙烯 | MnO2可与H2O2反应生成O2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸馏实验开始时应先加热后通冷凝水 | |
| B. | 不能用湿润的pH试纸测定溶液的pH,否则必然会使实验结果产生误差 | |
| C. | 提取海带中碘元素时,为保证I-完全氧化为I2,加入的氧化剂(H2O2或新制氯水)应过量 | |
| D. | 在中和热测定实验中,为准确测得反应前后的温差,应将已分别测得温度的氢氧化钠溶液与盐酸在量热剂中快速混合,并不断轻轻搅拌,测量混合液的最高温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18 g H2O中含有的质子数为10NA | |
| B. | 12 g C60中含有的碳原子数为60NA | |
| C. | 46 g NO2和N2O4混合气体中含有原子总数为3NA | |
| D. | 1 mol Na与足量O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食盐可做食物调味剂,也可做食品防腐剂 | |
| B. | 高锰酸钾溶液、酒精、双氧水都能杀菌消毒,都利用了强氧化性 | |
| C. | 海水淡化的方法主要有蒸馏法、离子交换法等 | |
| D. | 通常所说的三大合成材料是指塑料、合成橡胶和合成纤维 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4 | B. | 5 | C. | 6 | D. | 7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.2g | B. | 6.4g | C. | 9.6g | D. | 12.8g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
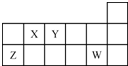
| A. | 原子半径的大小顺序:rZ>rY>rX | |
| B. | Y的简单氢化物水溶液呈酸性 | |
| C. | Y的氢化物与W的氢化物不能发生反应 | |
| D. | X、Y、Z、W四种元素的最高价氧化物对应水化物均能与强碱反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com