
| »ÆѧŹ½ | pKsp | pH | |
| æŖŹ¼³ĮµķŹ± | ³ĮµķĶźČ«Ź± | ||
| Mg£ØOH£©2 | / | 10.8 | 13.3 |
| Cu£ØOH£©2 | / | 4.4 | / |
| Fe£ØOH£©3 | / | 1.5 | / |
| Al£ØOH£©3 | 33 | / | / |
| A£® | Mg£ØOH£©2²»ČÜÓŚpH=7µÄCH3COONH4ČÜŅŗ | B£® | PKsp[Mg£ØOH£©2]£¾PKsp[Cu£ØOH£©2] | ||
| C£® | Fe£ØOH£©3µÄPKsp=38.5 | D£® | Al3+ŌŚČÜŅŗÖŠ³ĮµķĶźČ«µÄpH=5 |
·ÖĪö A£®ŅĄ¾Ż±ķÖŠŹż¾Ż½įŗĻČܶȻż³£Źż±ķ“ļŹ½¼ĘĖćĒāŃõ»ÆĆ¾µÄKsp£¬Č»ŗóŅĄ¾ŻČܶȻż¹ęŌņÅŠ¶Ļ½ā“š£»
B£®ŅĄ¾ŻČܶȻż³£Źż±ķ“ļŹ½¼ĘĖćPKsp[Mg£ØOH£©2]”¢PKsp[Cu£ØOH£©2]£»
C£®ŅĄ¾ŻČܶȻż³£Źż±ķ“ļŹ½¼ĘĖćFe£ØOH£©3µÄPKsp£¬ŅĄ¾ŻPKsp £ØPKsp=-lgKsp £©½ā“š£»
D£®ŅĄ¾ŻPKsp[Al£ØOH£©3]=33¼ĘĖćKsp[Al£ØOH£©3]£¬ŅĄ¾ŻKsp[Al£ØOH£©3]=[Al3+][OH-]3£¬¼ĘĖć½ā“š£®
½ā“š ½ā£ŗA£®PH=10.8£¬C£ØOH-£©=10-3.2mol/L£¬ŌņKsp[£ØMg£ØOH£©2]=0.1”Į£Ø10-3.2£©2=10-7.4£¬pH=7£¬C£ØOH-£©=10-7mol/L£¬ŌņQc=0.1”Į£Ø10-7£©2=10-15£¬
Qc£¼Ksp£¬ĖłŅŌMg£ØOH£©2ČÜÓŚpH=7µÄCH3COONH4ČÜŅŗ£¬¹ŹA“ķĪó£»
B£®PH=4.4£¬C£ØOH-£©=10-8.6mol/L£¬ŌņKsp[£ØCu£ØOH£©2]=0.1”Į£Ø10-8.6£©2=10-18.2£¬PKsp[£ØCu£ØOH£©2]=-lg10-18.2=18.2£»Ksp[£ØMg£ØOH£©2]=0.1”Į£Ø10-3.2£©2=10-7.4£¬PKsp[£ØMg£ØOH£©2]=-lg10-7.4=7.4£¬ĖłŅŌPKsp[Mg£ØOH£©2]£¼PKsp[Cu£ØOH£©2]£¬¹ŹB“ķĪó£»
C£®pH=1.5£¬C£ØOH-£©=£Ø10-12.5£©mol/L£¬Ōņ£ŗKsp[Fe£ØOH£©3]=0.1”Į£Ø10-12.5£©3=10-38.5£¬PKsp[Fe£ØOH£©3]=-lg10-38.5=38.5£¬¹ŹCÕżČ·£»
D£®PKsp[Al£ØOH£©3]=33£¬ŌņKsp[Al£ØOH£©3]=10-33£¬Ē”ŗĆ³ĮµķĶźČ«Ź±£¬[Al3+]=10-6£¬Ōņ£ŗKsp[Al£ØOH£©3]=[Al3+][OH-]3£¬[OH-]3=$\frac{Ksp}{[A{l}^{3+}]}$=$\frac{1{0}^{-33}}{1{0}^{-6}}$=
10-27£¬Ōņ£ŗ£¬[OH-]=$\root{3}{10{\;}^{-27}}$=10-9£¬[H+]=$\frac{10{\;}^{-14}}{10{\;}^{-9}}$=10-5£¬PH=-lg10-5=5£¬¹ŹDÕżČ·£»
¹ŹŃ”£ŗCD£®
µćĘĄ ±¾Ģāæ¼²éĮĖ³ĮµķČܽāĘ½ŗāµÄÓŠ¹Ų¼ĘĖć£¬ŹģĻ¤ČܶȻż³£Źż±ķ“ļŹ½£¬ČܶȻż¹ęŌņŹĒ½āĢā¹Ų¼ü£¬ĢāÄæÄѶČÖŠµČ£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ÖŠŗĶ10 mL 0.1mol•L-1 “×ĖįÓėÖŠŗĶ100 mL 0.01mol•L-1 µÄ“×ĖįĖłŠčĶ¬ÖÖ¼īČÜŅŗµÄÓĆĮæ²»Ķ¬ | |
| B£® | Į½ÖÖ“×ĖįČÜŅŗµÄĪļÖŹµÄĮæÅØ¶Č·Ö±šc1ŗĶc2£¬pH·Ö±šĪŖaŗĶa+1£¬Ōņc1=10c2 | |
| C£® | ³£ĪĀĻĀ£¬pH=11µÄNaOHČÜŅŗÓėpH=3µÄ“×ĖįČÜŅŗµČĢå»ż»ģŗĻ£¬µĪČėŹÆČļČÜŅŗ³ŹŗģÉ« | |
| D£® | Ļņ0.1mol/LµÄ°±Ė®ÖŠ¼ÓČėÉŁĮæĮņĖįļ§¹ĢĢ壬ŌņČÜŅŗÖŠ$\frac{c£ØO{H}^{-}£©}{c£ØN{H}_{3}•{H}_{2}O£©}$Ōö“ó |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ¶ąŃ”Ģā
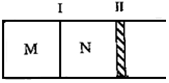 ČēĶ¼ĖłŹ¾øō°å¢ń¹Ģ¶Ø²»¶Æ£¬»īČū¢ņæÉ×ŌÓÉŅĘ¶Æ£¬M”¢NĮ½øöČŻĘ÷ÖŠ¾ł·¢ÉśČēĻĀ·“Ó¦£ŗA£Øg£©+3B£Øg£©?2C£Øg£©”÷H=-192kJ•mol-1£®³õŹ¼M”¢NČŻ»żĻąĶ¬£¬±£³ÖĪĀ¶Č²»±ä£¬ĻņM”¢NÖŠ·Ö±šĶØČėx mol AŗĶy mol BµÄ»ģŗĻĘųĢ壮ĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ£Ø””””£©
ČēĶ¼ĖłŹ¾øō°å¢ń¹Ģ¶Ø²»¶Æ£¬»īČū¢ņæÉ×ŌÓÉŅĘ¶Æ£¬M”¢NĮ½øöČŻĘ÷ÖŠ¾ł·¢ÉśČēĻĀ·“Ó¦£ŗA£Øg£©+3B£Øg£©?2C£Øg£©”÷H=-192kJ•mol-1£®³õŹ¼M”¢NČŻ»żĻąĶ¬£¬±£³ÖĪĀ¶Č²»±ä£¬ĻņM”¢NÖŠ·Ö±šĶØČėx mol AŗĶy mol BµÄ»ģŗĻĘųĢ壮ĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ£Ø””””£©| A£® | ČōĘ½ŗāŹ±AĘųĢåŌŚĮ½ČŻĘ÷ÖŠµÄĢå»ż·ÖŹżĻąµČ£¬ŌņxŅ»¶ØµČÓŚy | |
| B£® | Čōx£ŗy=1£ŗ2£¬ŌņĘ½ŗāŹ±£¬MÖŠµÄ×Ŗ»ÆĀŹ£ŗA£¼B | |
| C£® | Čōx£ŗy=1£ŗ3£¬µ±MÖŠ·Å³öČČĮæ172.8 kJŹ±£¬AµÄ×Ŗ»ÆĀŹĪŖ90% | |
| D£® | Čōx=1.4£¬y=1£¬NÖŠ“ļµ½Ę½ŗāŹ±Ģå»żĪŖ2L£¬CĪŖ0.4mol£¬Ōņ·“ӦʚŹ¼Ź±MµÄĢå»żĪŖ2.4L |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
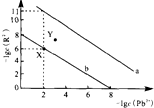 25”ꏱ£¬PbR£ØR2-ĪŖSO42-»ņCO32-£©µÄ³ĮµķČܽāĘ½ŗāĒśĻßČēĶ¼£®ŅŃÖŖKsp£ØPbCO3£©£¼Ksp£ØPbSO4£©£¬ĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ£Ø””””£©
25”ꏱ£¬PbR£ØR2-ĪŖSO42-»ņCO32-£©µÄ³ĮµķČܽāĘ½ŗāĒśĻßČēĶ¼£®ŅŃÖŖKsp£ØPbCO3£©£¼Ksp£ØPbSO4£©£¬ĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ£Ø””””£©| A£® | ĒśĻßa±ķŹ¾PbCO3 | |
| B£® | ŅŌPbSO4”¢Na2CO3ŗĶ½¹ĢæĪŖŌĮĻæÉÖʱøPb | |
| C£® | µ±PbSO4ŗĶPbCO3³Įµķ¹²“ꏱ£¬ČÜŅŗÖŠ$\frac{c£ØS{O}_{4}^{2-}£©}{c£ØC{O}_{3}^{2-}£©}$=105 | |
| D£® | ĻņXµć¶ŌÓ¦µÄ±„ŗĶČÜŅŗÖŠ¼ÓČėÉŁĮæPb£ØNO3£©2£¬æÉ×Ŗ»ÆĪŖYµć¶ŌÓ¦µÄČÜŅŗ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | µ„ÖŹµā | B£® | Įņ»ÆĒā | C£® | ĀČ»ÆĆ¾ | D£® | ĒāŃõ»ÆÄĘ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
 Įņ-µāŃ»··Ö½āĖ®ÖĘĒāÖ÷ŅŖÉę¼°ĻĀĮŠ·“Ó¦£ŗ
Įņ-µāŃ»··Ö½āĖ®ÖĘĒāÖ÷ŅŖÉę¼°ĻĀĮŠ·“Ó¦£ŗ²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | µČĮæµÄĮņÕōĘųŗĶĮņ¹ĢĢåŌŚŃõĘųÖŠ·Ö±šĶźČ«Č¼ÉÕ£¬·Å³öČČĮæŅ»Ńł¶ą | |
| B£® | ŠčŅŖ¼ÓČČ²ÅÄÜ·¢ÉśµÄ·“Ó¦Ņ»¶ØŹĒĪüČČ·“Ó¦ | |
| C£® | ŌŚ101kpaŹ±£¬2gH2ĶźČ«Č¼ÉÕ£¬Éś³ÉŅŗĢ¬Ė®£¬·Å³ö285.8kJČČĮ棬ŌņĒāĘųČ¼ÉÕµÄČČ»Æѧ·½³ĢŹ½±ķŹ¾ĪŖ£ŗ2H2£Øg£©+O2£Øg£©ØT2H2O£Øl£©”÷H=-285.8kJ/mol | |
| D£® | ŌŚĒæĖįĒæ¼īĻ”ČÜŅŗÖŠ£ŗH+£Øaq£©+OH-£Øaq£©=H2O£Øl£©”÷H=-57.3kJ/mol£¬Čō½«ŗ¬1molNaOHµÄČÜŅŗŗĶŗ¬0.5molH2SO4µÄÅØĮņĖį»ģŗĻ£¬·Å³öµÄČČĮæ“óÓŚ57.3 kJ |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com