
| A. | 硝酸的标签上应标注 和 和 | B. | 硫离子结构示意图: | ||
| C. | HClO的电子式: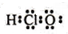 | D. | 239Pu比235U原子核内多4个中子 |
分析 A、警示标记标注 和
和 说明该物质具有较低的燃点和腐蚀性,据此解答.
说明该物质具有较低的燃点和腐蚀性,据此解答.
B、硫离子的核电荷数为16、核外电子数为18;
C、氯原子最外层7个电子成1个共价键、氧原子的最外层6个电子,成2个共价键;
D、中子数=质量数-质子数,据此计算即可.
解答 解:A、硝酸具有强的氧化性和腐蚀性,应标注 和
和 ,故A错误;
,故A错误;
B、硫离子的核外电子数为18、核电荷数为16,硫离子结构示意图为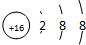 ,故B正确;
,故B正确;
C、氯原子最外层7个电子成1个共价键、氧原子的最外层6个电子,成2个共价键,电子式为 ,故C错误;
,故C错误;
D、U:中子数=质量数-质子数=235-92=143,Pu:中子数=质量数-质子数=239-94=145,145-143=2,故D错误;故选B.
点评 本题主要考查的是安全警示标识、离子结构示意图、电子式书写、中子数与质量数和质子数的关系等,难度不大.


科目:高中化学 来源: 题型:选择题
| 1 | 2 | 3 | 4 | 5 | 6 | … |
| … | C2H6 | C5H12 | C8H18 | … | … | … |
| A. | C16H34 | B. | C17H36 | C. | C26H54 | D. | C27H56 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 乙元素的族序数比甲元素的族序数大 | |
| B. | 甲、丙元素最高价氧化物对应水化物的酸性强弱顺序:甲>丙 | |
| C. | 原子半径由大到小的顺序:丙>甲>乙 | |
| D. | 含乙元素的化合物数目比含甲或丙元素的化合物数目多 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 Cu、Ag、Au同为第一副族的元素,它们的性质也有不同之处,如:它们在水溶液中最稳定的氧化态分别为+2,+1和+3,回答下列问题:
Cu、Ag、Au同为第一副族的元素,它们的性质也有不同之处,如:它们在水溶液中最稳定的氧化态分别为+2,+1和+3,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③⑤ | B. | ②③ | C. | ③④ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
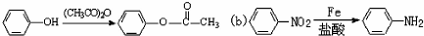
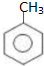 ;
;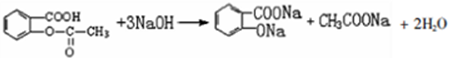 ;
;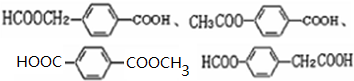 ;
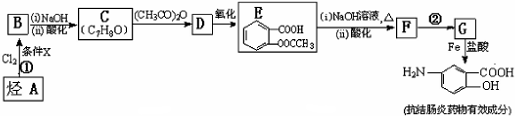
;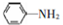 易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,而当苯环上连有羧基时则取代在间位.据此写出以A为原料合成化合物
易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,而当苯环上连有羧基时则取代在间位.据此写出以A为原料合成化合物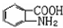 的合成路线
的合成路线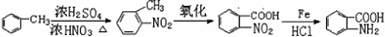 ..(依照题中抗结肠炎药物有效成分的合成路线的表达方式答题)
..(依照题中抗结肠炎药物有效成分的合成路线的表达方式答题)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色溶液:Cu2+、K+、MnO4-、SO42- | |
| B. | 能溶解Al2O3的溶液:Na+、Ca2+、HCO3-、NO3- | |
| C. | 常温下c(OH-)=1×10-13mol•L-1的溶液:NH4+、Al3+、SO42-、Cl- | |
| D. | 含0.1 mol•L-1 NO3-的溶液:H+、Fe2+、Mg2+、Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定是IIA元素 | |
| B. | 一定是金属元素 | |
| C. | 一定是正二价元素 | |
| D. | 可能是金属元素,也可能是非金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Li是最轻的金属,也是活动性极强的金属,是制造电池的理想物质 | |
| B. | 燃料电池的能量转化率可达100% | |
| C. | 电解质为NH4Cl的锌锰干电池比电解质KOH锌锰干电池使用寿命长 | |
| D. | 钢铁在海水中比在河水中更易被腐蚀,主要原因是海水含氧量高 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com