

| 物质 | 熔点/℃ | 沸点/℃ | 溶解性 |
| 乙酰苯胺 | 114.3 | 305 | 微溶于冷水,易溶于热水 |
| 苯胺 | -6 | 184.4 | 微溶于水 |
| 醋酸 | 16.6 | 118 | 易溶于水 |
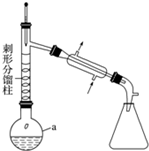
分析 (1)根据装置图分析;圆底烧瓶所盛放的溶液体积一般不能超过烧瓶容积的$\frac{2}{3}$,不能低于$\frac{1}{3}$;
(2)苯胺易被氧化,加入锌粉,防止苯胺被氧化,同时起着沸石的作用,防止暴沸;
(3)根据乙酸和水的沸点分析;
(4)反应生成水,若不再生成水,说明完全;
(5)若让反应混合物冷却,会有固体析出;
(6)乙酰苯胺的溶解度受温度影响较大,且与乙酸、苯胺的溶解度相差较大,可以用重结晶的方法进行提纯.
(7)加入9mL (0.10mol)苯胺、15mL(0.27mol)冰醋酸及少许锌粉,所以乙酸过量,根据苯胺的物质的量计算出乙酰苯胺的物质的量和质量,再求出产率.
解答 解:(1)根据装置图可知a仪器为圆底烧瓶;反应物液体的总体积超过22mL,由于圆底烧瓶所盛放的溶液体积一般不能超过$\frac{2}{3}$,也不能低于$\frac{1}{3}$,因此最佳规格是50mL,
故答案为:圆底烧瓶;B;
(2)苯胺易被氧化,加入锌粉,防止苯胺被氧化,同时起着沸石的作用,防止暴沸,
故答案为:防止苯胺被氧化,同时起着沸石的作用;
(3)已知醋酸的沸点为118℃,水的沸点为100℃,温度过高,未反应的乙酸会蒸出,降低反应物的利用率,温度过低,又不能除去反应生成的水,故选择控制温度计约105℃,
故答案为:温度过低不能蒸出反应所生成的水或温度过高未反应的乙酸蒸出;
(4)反应生成水,水经过加热蒸发、冷凝进入锥形瓶中,若锥形瓶中水的量不再增加,说明反应基本完全,故答案为:锥形瓶不再有水增加;
(5)已知乙酰苯胺的熔点为114.3℃,常温下为固体,若让反应混合物冷却,则乙酰苯胺会以固体形式析出沾在瓶壁上不易处理,故需要“趁热”过滤;
故答案为:若让反应混合物冷却,则固体析出沾在瓶壁上不易处理;
(6)乙酰苯胺的溶解度受温度影响较大,且与乙酸、苯胺的溶解度相差较大,可以用重结晶的方法进行提纯,故答案为:重结晶;
(7)加入9mL (0.10mol)苯胺、15mL(0.27mol)冰醋酸及少许锌粉,所以乙酸过量,按照苯胺的物质的量计算,
设生成的乙酰苯胺为xmol, NH2+CH3COOH$\stackrel{△}{?}$
NH2+CH3COOH$\stackrel{△}{?}$ NHCOOCH3 +H2O
NHCOOCH3 +H2O
1mol 1mol
0.1mol x
则x=0.1mol,所以m(乙酰苯胺)=0.1mol×135g/mol=13.5g,
所以所得到乙酰苯胺的产率是$\frac{10.8g}{13.5g}$×100%=80%;
故答案为:80%.
点评 本题考查有机物制备方案设计,为高频考点,侧重于学生的分析、实验能力的考查,题目涉及物质的分离提纯、对操作的分析评价、基本操作等,理解实验原理和物质的性质是解题的关键,是对学生综合能力的考查,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 江河入海口容易形成三角洲 | |
| B. | 当日光从窗隙射入暗室时,可观察到一束光线 | |
| C. | 向氢氧化铁与水形成的某分散系中插入正、负电极,通直流电一段时间后,一极附近颜色变深 | |
| D. | 向氯化铁溶液中加入氢氧化钠溶液,产生红褐色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化铁与盐酸反应OH-+H+═H2O | |
| B. | 用稀硫酸清除铁锈Fe2O3+6H+═2Fe3++3H2O | |
| C. | 食盐水中滴加硝酸银溶液Cl-+Ag+═AgCl↓ | |
| D. | 氢氧化钡跟硫酸铜溶液的反应Ba2++2OH-+Cu2++SO42-═BaSO4↓+Cu(OH)2↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com