
一定条件下,在密闭容器中能表示反应X(g)+2Y(g)2Z(g)一定达到平衡状态的是( )
①X、Y、Z的物质的量之比为1:2:2 ②X、Y、Z的浓度不再发生变化 ③容器中的压强不再发生变化 ④单位时间内生成n mol Z,同时生成2n mol Y
A.①② B.①④
C.②③ D.③④
 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案科目:高中化学 来源: 题型:
太阳能的开发和利用是21世纪一个重要课题。利用储能介质储存太阳能的原理是:白天在太阳照射下某种盐熔化,吸收热量,晚间熔盐固化释放出相应的能量,已知下表数据:
| 盐 | 熔点(℃) | 熔化吸热(kJ·mol-1) | 参考价格(元·t-1) |
| CaCl2·6H2O | 29.9 | 37.3 | 780~850 |
| Na2SO4·10H2O | 32.4 | 77.0 | 800~900 |
| Na2HPO4·12H2O | 35.1 | 100.1 | 1 600~2 000 |
| Na2S2O3·5H2O | 45.0 | 49.7 | 1 400~1 800 |
其中最适宜选用作为储能介质的是( )
A.CaCl2·6H2O B.Na2SO4·10H2O
C.Na2HPO4·12H2O D.Na2S2O3·5H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
有机物的结构可用“键线式”简化表示,如CH3—CH===CH—CH3可简写为。有机物X的键线式为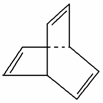 。
。
(1)有机物Y是X的同分异构体,且属于芳香烃,写出Y的结构简式:____________________。
(2)Y与乙烯在一定条件下发生加聚反应,写出反应的化学方程式:______________________________________________。
(3)X与足量的H2在一定条件下反应可生成环状的饱和烃Z,Z的一氯代物有________种。
查看答案和解析>>
科目:高中化学 来源: 题型:
向体积为Va的0.05 mol·L-1 CH3COOH溶液中加入体积为Vb的0.05 mol·L-1 KOH溶液,下列关系错误的是( )
A.Va>Vb时:c(CH3COOH)+c(CH3COO-)>c(K+)
B. Va=Vb时:c(CH3COOH)+c(H+)=c(OH-)
C. Va<Vb时:c(CH3COO-)>c(K+)>c(OH-)>c(H+)
D. Va与Vb任意比时:c(K+)+c(H+)=c(OH-)+c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
现有电解质溶液:①Na2CO3 ②NaHCO3 ③NaAlO2 ④CH3COONa ⑤NaOH,且已知:CO2+3H2O+2AlO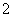 ===2Al(OH)3↓+CO
===2Al(OH)3↓+CO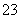 。
。
(1)当五种溶液的pH相同时,其物质的量浓度由大到小的顺序是__________________。
(2)将上述物质的量浓度均为0.1 mol·L-1的五种溶液,稀释相同倍数时,其pH变化最大的是________(填编号)。
(3)在上述五种电解质溶液中,分别加入AlCl3溶液,有气体产生的是________(填编号)。
(4)将上述①②③④四种电解质溶液混合时,发生反应的离子方程式为_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
COCl2(g)CO(g)+Cl2(g) ΔH>0。当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO的浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是( )
A.①②④ B.①④⑥
C.②③⑥ D.③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
在一个固定容积的密闭容器中充入2 mol A和1 mol B,发生反应:2A(g)+B(g)xC(g),达到平衡后,C的体积分数为w%。若维持容器体积和温度不变,将0.6 mol A、0.3 mol B和1.4 mol C充入该容器中,达平衡后,C的体积分数也为w%,则x值为( )
A.只能为2
B.只能为3
C.可能是2,也可能是3
D.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是( )
①CH3OH(g)+H2O(g)===CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1
②CH3OH(g)+ O2(g)===CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
O2(g)===CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
下列说法正确的是( )
A.CH3OH的标准燃烧热为-192.9 kJ·mol-1
B.反应①中的能量变化如图所示
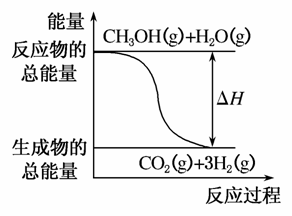
C.CH3OH转变成H2的过程一定要吸收能量
D.根据②推知反应CH3OH(l)+ O2(g)===CO2(g)+2H2(g)的ΔH>-192.9 kJ·mol-1
O2(g)===CO2(g)+2H2(g)的ΔH>-192.9 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
高锰酸钾分别在酸性、中性、碱性条件下发生的反应如下:
MnO +5e-+8H+===Mn2++4H2O
+5e-+8H+===Mn2++4H2O
MnO +3e-+2H2O===MnO2↓+4OH-
+3e-+2H2O===MnO2↓+4OH-
MnO +e-===MnO
+e-===MnO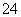 (溶液呈绿色)
(溶液呈绿色)
(1)从上述三个半反应中可以看出高锰酸根离子被还原的产物受溶液的________影响。
(2)将SO2通入高锰酸钾溶液中,发生还原反应的离子反应过程为________________________________________________________。
(3)将PbO2投入酸性MnSO4溶液中搅拌,溶液变为紫红色。下列说法正确的是________(填序号)。
a.氧化性:PbO2>KMnO4
b.还原性:PbO2>KMnO4
c.MnSO4溶液可以用盐酸酸化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com