
食品保鲜膜按材质分为聚乙烯(PE)、聚氯乙烯(PVC)等种类。PE保鲜膜可直接接触食品,PVC保鲜膜则不能直接接触食品,它对人体有潜在危害。下列有关叙述不正确的是 ( )
A.PE、PVC都属于链状高分子化合物,受热易熔化
B.PE、PVC的单体都是不饱和烃,能使溴水褪色
C.焚烧PVC保鲜膜会放出有毒气体如HCl
D.废弃的PE和PVC均可回收利用以减少白色污染
 优等生题库系列答案
优等生题库系列答案 53天天练系列答案
53天天练系列答案科目:高中化学 来源: 题型:
以下生活中的现象不可用原电池原理来解释的是 ( )。
A.黄铜(铜锌合金)制作的铜锣不易产生铜绿
B.生铁比软铁芯(几乎是纯铁)容易生锈
C.铁质器件附有铜质配件,在接触处易生铁锈
D.银质奖章久置后表面变暗
查看答案和解析>>
科目:高中化学 来源: 题型:
在密闭容器中,将起始浓度均为2mol/L的CO和H2O混合加热到400℃,发生下列反应:CO(g) + H2O(g) 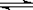 CO2(g) + H2(g),一段时间后该反应达到平衡,测得CO的浓度为0.5mol/L,则:
CO2(g) + H2(g),一段时间后该反应达到平衡,测得CO的浓度为0.5mol/L,则:
(1)平衡时CO的转化率为 ;该反应在该温度时的化学平衡常数为 。
(2)在相同的条件下,如果H2O和CO的起始浓度变为4mol/L,则CO的转化率为 。
(3)800℃时,该反应的平衡常数为1,则该反应的△H 0(填 >,<, =)
(4)改变起始条件,在一体积为10 L的容器中,通入一定量的CO和H2O,在850℃时发生上述反应,CO和H2O浓度变化如右下图,则0~4 min的平均反应速率v(CO)=______mol / (L·min)
(5)t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如左下表:
 t℃时物质浓度(mol / L)的变化
t℃时物质浓度(mol / L)的变化
| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0138 | 0.238 | 0.062 | 0.062 |
| 3 | C1 | C2 | C3 | C3 |
| 4 | C1 | C2 | C3 | C3 |
| 5 | 0.116 | 0.216 | 0.084 | 0.104 |
| 6 | 0.096 | 0.266 |
①表中3 min ~ 4 min之间反应处于 状态; C1数值___0.08mol / L(填大于、小于或等于)。
②反应在4 min ~ 5 min问,平衡向逆方向移动,可能的原因是________(单选),
表中5 min ~ 6 min之间数值发生变化,可能的原因是________(单选)。
A.增加水蒸气 B.降低温度 C.使用催化剂 D.增加氢气浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
丁烷(分子式C4H10)广泛应用于家用液化石油气,也用于打火机中作燃料,下列关于丁烷叙述不正确的是( )
A.在常温下,C4H10是气体
B.C4H10与CH4互为同系物
C.丁烷有正丁烷与异丁烷两种同分异构体
D.C4H10进行一氯取代后生成两种沸点不同的产物
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于化石燃料的加工说法正确的是( )
A.石油裂化主要得到乙烯
B.石油分馏是化学变化,可得到汽油、煤油
C.煤干馏主要得到焦炭、煤焦油、粗氨水和焦炉气
D.煤制煤气是物理变化,是高效、清洁地利用煤的重要途径
查看答案和解析>>
科目:高中化学 来源: 题型:
下列过程与加成反应有关的是( )
A.苯与溴水混合振荡,水层颜色变浅
B.乙烯与溴水混合振荡,水层颜色变浅
C.乙烯与高锰酸钾溶液混合振荡,溶液颜色变浅
D.甲烷与氯气混合光照,气体颜色变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
乙酰乙酸乙酯(CH3COCH2COOC2H5)是一种不溶于水的液体,熔点:-45 ℃,沸点:180.8 ℃,它是有机合成中常用的原料。在实验室,它可以由乙酸乙酯在乙醇钠的催化作用下缩合而制得,反应式为
2CH3COOC2H5C2H5ONa,CH3COCH2COOC2H5+C2H5OH
反应中催化剂乙醇钠是由金属钠和残留在乙酸乙酯中的微量乙醇作用生成的,而一旦反应开始,生成的乙醇又会继续和钠反应生成乙醇钠。乙酰乙酸乙酯制备的流程如下:
金属钠,有机液体回流①,钠熔化振荡②,小米状钠珠回收有机液体③,加入乙酸乙酯④,橘红色溶液乙酸酸化⑤,含乙酰乙酸乙酯的混合物⑥,⑦,乙酰乙酸乙酯粗产品
阅读下面关于乙酰乙酸乙酯制备的实验过程,并回答有关问题。
(1)将适量干净的金属钠放入烧瓶中,为了得到小米状的钠珠,需将钠熔化,为了防止钠的氧化,熔化时需在钠上覆盖一层有机液体,下表是钠和一些常用有机液体的物理性质:
| 钠 | 苯 | 甲苯 | 对二甲苯 | 四氯化碳 | |
| 密度/(g·cm-3) | 0.97 | 0.88 | 0.87 | 0.86 | 1.60 |
| 熔点/℃ | 97.8 | 5.5 | -95 | 13.3 | -22.8 |
| 沸点/℃ | 881.4 | 80 | 111 | 138.4 | 76.8 |
最好选用________来熔化钠。是否能用四氯化碳?________(填“是”或“否”),理由是________________________________________________________________________。
(2)将烧瓶中的有机液体小心倾出,迅速加入适量乙酸乙酯,装上带有一根长玻璃导管的单孔胶塞,并在导管上端接一个干燥管。缓缓加热,保持瓶中混合液微沸状态。在实验中,使用烧瓶必须干燥,原料乙酸乙酯必须无水,原因是_______________________________,
烧瓶配上长导管的作用是______________________________________________,
导管上端接一干燥管的目的是______________________________________________。
(3)步骤⑥为向混合溶液中加入饱和食盐水,其目的是
________________________________________________________________________,
写出步骤⑦实验操作的主要仪器____________(填最主要一种)。
粗产品(含乙酸乙酯和少量水及乙酸等)经过几步操作,最后成为纯品。
粗产品无水硫酸钠,过滤,水浴蒸馏,减压蒸馏,乙酰乙酸乙酯
(4)向分离出的乙酰乙酸乙酯粗产品中加无水硫酸钠固体的作用是________________________________________________________________________。
(5)精馏乙酰乙酸乙酯时需要减压蒸馏,装置如图所示。
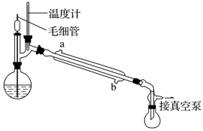
冷凝管的进出水方向应________口进,________口出(填“a”或“b”)。毛细管的作用是________________________________________________________________________。
(6)实验最后所得产品远少于完全转化的理论产值,除了反应过程中的损耗外,主要原因是________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com