
【题目】用0.1mol·L-1NaOH溶液滴定20mL0.1mol·L-1H2SO3溶液,所得滴定曲线如图所示(忽略混合时溶液体积的变化)。下列叙述不正确的是( )
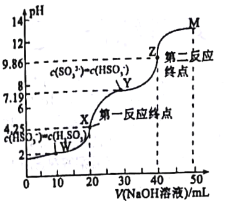
A.Ka2(H2SO3)的数量级为10-8
B.向X点加入少量澄清石灰水溶液,![]() 的值增大
的值增大
C.若将n(NaHSO3)与n(Na2SO3)=1:1混合,对应的点应在Y、Z之间
D.图中溶液中水的电离程度:W<X<Y<Z
【答案】C
【解析】
用0.1mol/LNaOH溶液滴定40mL0.1mol/LH2SO4溶液,由于H2SO3是二元酸,滴定过程中存在两个化学计量点,滴定反应为:NaOH+H2SO3=NaHSO3+H2O,NaHSO3+NaOH=Na2SO3+H2O,完全反应需要消耗NaOH溶液的体积为40mL,结合溶液中的守恒思想判断分析。
A.Ka2(H2SO3)=![]() ,据图可知当c(SO32-)=c(HSO3-)时溶液pH=7.19,即c(H+)=10-7.19mol/L,此时Ka2(H2SO3)= c(H+)=10-7.19,故A正确;
,据图可知当c(SO32-)=c(HSO3-)时溶液pH=7.19,即c(H+)=10-7.19mol/L,此时Ka2(H2SO3)= c(H+)=10-7.19,故A正确;
B.![]() ,温度不变平衡常数不变,加入少量澄清石灰水溶液碱性增强,c(H+)减小,所以该比值增大,故B正确;
,温度不变平衡常数不变,加入少量澄清石灰水溶液碱性增强,c(H+)减小,所以该比值增大,故B正确;
C.当滴入30mLNaOH溶液时,溶液中的溶质恰好为等物质的量的亚硫酸氢钠和亚硫酸钠,据图可知此时溶液显碱性,所以SO32-的水解程度>HSO3-的电离程度,所以c(SO32-)<c(HSO3-);根据滴定过程发生的反应可知,随着NaOH加入的量增多,c(SO32-)变大,c(HSO3-)减少,Y点c(SO32-)=c(HSO3-),则当c(SO32-)<c(HSO3-)时,对应Y点之前的某个点,故C错误;
D.酸或碱的电离抑制水的电离,盐类的水解促进水的电离,所以当溶液中的溶质只有Na2SO3时水的电离程度达到最大,再未完全反应之前,随着NaOH的滴入水的电离程度逐渐增大,所以水的电离程度W<X<Y<Z,故D正确;
故答案为C。


科目:高中化学 来源: 题型:
【题目】下列表示化学反应A(g)+2B(g)=3C(g)+D(g)在不同条件下的反应速率,最快的是
A.υ(A)=0.3molL-1s-1B.υ(B)=0.5molL-1s-1
C.υ(C)=0.4molL-1s-1D.υ(D)=0.6molL-1s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型纳米材料MFe2Ox(3<x<4)中M表示+2价的金属元素,在反应中化合价不发生变化。常温下,MFe2Ox能使工业废气中的SO2转化为S,流程如下,则下列判断正确的是( )
![]()
A.MFe2Ox是氧化剂
B.SO2是该反应的催化剂
C.x<y
D.MFe2Oy是还原产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaCl是一种化工原料,可以制备一系列物质,如图所示。

请回答下列问题:
(1)上述流程框图中属于电解质且存在熔融态导电的是________,属于非电解质的是_______。
(2)H2和Cl2的反应属于______________________(填字母。
A.化合反应 b.离子反应 c.氧化还原反应
(3)电解饱和NaCl溶液的化学方程式为:2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑。该反应中氧化产物是___________,每转移0.2mol电子,共产生标准状况下气体的总体积是_____L。
2NaOH+H2↑+Cl2↑。该反应中氧化产物是___________,每转移0.2mol电子,共产生标准状况下气体的总体积是_____L。
(4)Na2CO3溶液中通入少量HCl,发生反应的离子方程式为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中不正确的是( )
A. 甲苯苯环上的1个氢原子被含3个碳原子的烷基取代,所得产物有6种
B. 已知丙烷的二氯代物有4种同分异构体,则其六氯代物的同分异构体也为4种
C. 含有5个碳原子的某饱和链烃,其一氯代物有3种
D. 菲的结构简式为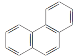 ,它与硝酸反应,可生成5种一硝基取代物
,它与硝酸反应,可生成5种一硝基取代物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二十世纪初德国化学家哈伯和工程师博施成功地开发了合成氨的生产工艺,为社会的发展和进步做出了重大贡献。如今科学家为提高氨的产量,以及对各种氨的化合物的研究仍做着各种有益的探索。试回答下列问题:
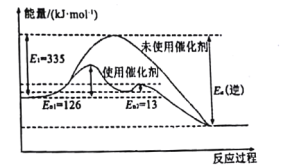
(1)N2(g)+3H2(g)![]() 2NH3(g) △H =-92.4kJ·mol-1如图所示,合成氨反应中未使用催化剂时,逆反应的活化能Ea(逆)=___kJ·mol-1。
2NH3(g) △H =-92.4kJ·mol-1如图所示,合成氨反应中未使用催化剂时,逆反应的活化能Ea(逆)=___kJ·mol-1。
(2)①在一定条件下,分别将lmolN2和3molH2置于容积恒定的密闭容器中,达化学平衡状态时,NH3的体积分数为10%,若保持其他条件不变,起始时改为充入2molN2和2molH2,达新平衡后,NH3的体积分数为___10%(填“>”、“<”或“=”)。
②某温度下,n(N2):n(H2)=1:3的混合气体在刚性容器内发生反应,起始时气体总压为p0Pa,平衡时气体总压为0.9p0Pa,气体分压(p分)=气体总压(p总)×体积分数,用某物质的平衡分压代替物质的量浓度也可以表示化学反应平衡常数(记作Kp),则此温度下,该反应的化学平衡常数Kp=___(用含p0的代数式表示)。
(3)合成氨需要的H2来源比较广泛,氢气的储存制备等问题也日益得到解决。在恒温恒容的密闭容器中,某储氢反应:MHx(s)+yH2(g)![]() MHx+2y(s)△H<0达到化学平衡。下列有关叙述正确的是(______)
MHx+2y(s)△H<0达到化学平衡。下列有关叙述正确的是(______)
a.容器内气体压强保持不变
b.吸收ymolH2需1molMHx
c.若向容器内通入少量氢气,新平衡后c(H2)比原平衡大
d.若向容器内通入少量氢气,则v(放氢)>v(吸氢)
(4)利用现代手持技术传感器可以探究压强对化学平衡移动的影响,如以2NO2(g)![]() N2O4(g)为例。在恒定温度和标准压强(100kPa)条件下,往针筒中充入一定体积的NO2气体后密封并保持活塞位置不变。分别在t1、t2时刻迅速移动活塞后并保持活塞位置不变(不考虑温度的变化)。测定针筒内气体压强变化如图所示:
N2O4(g)为例。在恒定温度和标准压强(100kPa)条件下,往针筒中充入一定体积的NO2气体后密封并保持活塞位置不变。分别在t1、t2时刻迅速移动活塞后并保持活塞位置不变(不考虑温度的变化)。测定针筒内气体压强变化如图所示:

①B、E两点对应的正反应速率大小为vB___vE(填“>”、“<”或“=”)。
②E、F、G、H四点时对应气体的平均相对分子质量最大的点为___。
(5)NH3能够和Ag+形成Ag(NH3)2+,溶液中存在Ag+(aq)+2NH3(aq)![]() Ag(NH3)2+(aq)常温下,K[Ag(NH3)2+]=1.10×107,反应AgCl(s)+2NH3(aq)
Ag(NH3)2+(aq)常温下,K[Ag(NH3)2+]=1.10×107,反应AgCl(s)+2NH3(aq)![]() Ag(NH3)2(aq)++Cl-(aq)的化学平衡常数K=1.936×10-3,则Ksp(AgCl)=___。
Ag(NH3)2(aq)++Cl-(aq)的化学平衡常数K=1.936×10-3,则Ksp(AgCl)=___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,向体积为1L的密闭容器中充入1molCO2和4molH2,测得CO2和CH3OH(g)的浓度随时间的变化如图所示。下列叙述中正确的是
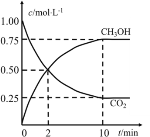
A.该反应的化学方程式为:CO2(g)+4H2(g)2CH3OH(g)
B.10min时,反应停止
C.2min时,CO2的消耗速率等于CH3OH的消耗速率
D.从反应开始到平衡,H2的平均反应速率v(H2)=0.225mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现向一密闭容器中充入1 mol N2和3 mol H2,在一定条件下使该反应发生:N2+3H2![]() 2NH3。下列有关说法正确的是
2NH3。下列有关说法正确的是
A.达到化学反应最大限度时,正反应和逆反应的速率都为零
B.当符合:3正N2=正H2时,反应达到最大限度
C.达到化学最大限度时,单位时间消耗a mol N2,同时生成3a mol H2
D.当N2、H2、NH3的分子数比为1∶3∶2,反应达到最大限度态
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com