
| NaOH溶液 | 银氨溶液 | 新制Cu(OH)2 | 金属钠 | |
| A | 发生中和反应 | 不反应 | 溶解 | 生成氢气 |
| B | 不反应 | 有银镜反应 | 有红色沉淀 | 放出氢气 |
| C | 发生水解反应 | 有银镜反应 | 有红色沉淀 | 不反应 |
| D | 发生水解反应 | 不反应 | 不反应 | 不反应 |
分析 A能与NaOH发生中和反应且能溶解Cu(OH)2,说明含有-COOH;B能发生银镜反应,说明含有-CHO,能与Na发生生产氢气,说明含有-OH;C能发生水解,且能发生银镜反应,说明含有-OOCH,为甲酸酯;D能水解,含有酯基,结合分子式可确定有机物的结构简式.
解答 解:A能与NaOH发生中和反应且能溶解Cu(OH)2,说明含有-COOH,应为CH3CH2COOH;B能发生银镜反应,说明含有-CHO,能与Na发生生产氢气,说明含有-OH,应为CH3CHOHCHO或CH2OHCH2CHO;C能发生水解,且能发生银镜反应,说明含有-OOCH,为甲酸酯,应为HCOOCH2CH3,名称为甲酸乙酯,D能水解,含有酯基,应为CH3COOCH3,名称为乙酸甲酯,
故答案为:CH3CH2COOH;CH3CHOHCHO;HCOOCH2CH3;CH3COOCH3.
点评 本题考查有机物的推断,为高频考点,注意根据有机物的分子式写出可能的同分异构体的结构简式,根据有机物的性质判断可能的结构,把握有机物官能团的性质为解答的关键,侧重分析与推断能力的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题
 已知下列数据:
已知下列数据:| 物质 | 熔点(℃) | 沸点(℃) | 密度(g•cm-3) |
| 乙醇 | -117.0 | 78.0 | 0.79 |
| 乙酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.90 |
| 浓硫酸(98%) | - | 338.0 | 1.84 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
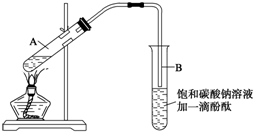
 “酒是陈的香”,是因为酒在储存过程中生成了有香味的乙酸乙酯.在实验室我们可以用如图所示的装置来制取乙酸乙酯.回答下列问题:
“酒是陈的香”,是因为酒在储存过程中生成了有香味的乙酸乙酯.在实验室我们可以用如图所示的装置来制取乙酸乙酯.回答下列问题: CH3COOCH2CH3+H2O.
CH3COOCH2CH3+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 实验 序号 | 浓度 mol•L-1 温度(℃)时间( min) | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 1 | 800 | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800 | c2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800 | c3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应①中电能转化为化学能 | |
| B. | 反应②为放热反应 | |
| C. | 反应③使用催化剂,△H3减小 | |
| D. | 反应CH4(g)=C(s)+2H2(g)的△H3=74.8kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
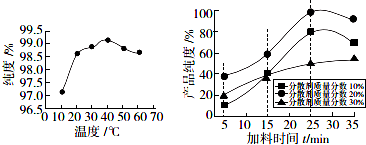
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com