
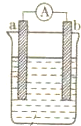
 如图为某化学兴趣小组进行不同条件下化学能转变为电能探究的装置.请你回答下列问题:
如图为某化学兴趣小组进行不同条件下化学能转变为电能探究的装置.请你回答下列问题:

 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | 名称 | 结构简式 | 单体 |
| 1 | 涤纶 (的确凉) |
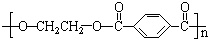 |
|
| 2 | 异戊橡胶 | 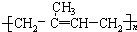 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 甲 | 乙 | 丙 | |
| 所含元素 | C、H | C、H、F | C、H、F |
| 所含电子数 | 26 | ||
| 结构特点 | 饱和有机物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图是周期表中短周期的一部分,若a原子最外层电子数比次外层少了3个,则下
如图是周期表中短周期的一部分,若a原子最外层电子数比次外层少了3个,则下| A、a与c不能形成化合物 |
| B、通常情况下,a、b、c的单质均有颜色 |
| C、氢化物的水溶液酸性(相同条件下):c>b |
| D、原子半经的大小顺序是:c>b>a>d |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com