
硫代硫酸钠溶液与稀硫酸反应的化学方程式为:
Na2S2O3+H2SO4=Na2SO4+SO2+S↓+H2O,下列各组实验中最先出现浑浊的是 ( )
| 实验 | 反应温度/℃ | Na2S2O3溶液 | 稀H2SO4 | H2O | ||
| V/mL | c/(mol·L-1) | V/mL | c/(mol·L-1) | V/mL | ||
| A | 25 | 5 | 0.1 | 10 | 0.1 | 5 |
| B | 25 | 5 | 0.2 | 5 | 0.2 | 10 |
| C | 35 | 5 | 0.1 | 10 | 0.1 | 5 |
| D | 35 | 5 | 0.2 | 10 | 0.2 | 5 |
 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案科目:高中化学 来源: 题型:
关于氢键的下列说法正确的是
A.由于氢键的作用,熔点H2O>I2
B.4℃时,水的密度最大与氢键有关
C.氢键不属于化学键,没有饱和性和方向性
D.氢键一定在分子间形成,它是一种特殊的分子间作用力
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组元素的性质递变情况错误的是( )
A.Li、Be、B原子最外层电子数依次增多
B.P、S、Cl元素最高正价依次升高
C.N、O、F原子半径依次增大
D.Na、K、Rb的金属性依次增强
查看答案和解析>>
科目:高中化学 来源: 题型:
化合物A由周期不同的短周期元素X、Y组成,是良好的耐热冲击材料。
(1)X的单质既可与盐酸反应,又可与NaOH溶液反应,X的原子结构示意图为________。
(2)X的硫酸盐溶液与过量NaOH溶液反应的离子方程式为___________________________________________________。
(3)一定条件下,A和水缓慢作用生成含Y的化合物Z,Z分子含有10个电子。
①Z与H2O2反应,其产物之一是Y的单质,Y的单质的电子式为________;Z分子的结构呈________。
②A的化学式是________。
(4)X的单质、石墨和二氧化钛(TiO2)按比例混合,高温下反应得到的化合物均由两种元素组成,且都是新型陶瓷材料(在火箭和导弹上有重要应用),其反应的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
NO和CO都是汽车尾气中的有害物质,它们能缓慢地反应生成氮气和二氧化碳,对此反应,下列叙述正确的是 ( )
A.改变压强,不能改变该反应速率
B.使用适当的催化剂能改变该反应速率
C.升高温度不一定能提高该反应速率
D.使用催化剂后,该反应速率之比不等于计量数之比了
查看答案和解析>>
科目:高中化学 来源: 题型:
分析题目中的图表信息,根据信息完成填空。
Ⅰ.在恒温条件下将一定量X和Y的混合气体通入一容积为2 L的密闭容器中,X和Y两物质的浓度随时间变化情况如下图。
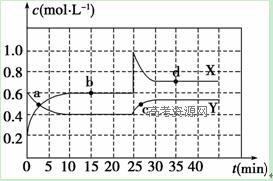
(1)该反应的化学方程式为(反应物或生成物用符号X、Y表示):
_______________________________________________________。
(2)a、b、c、d四个点中,表示化学反应处于平衡状态的点是________________。
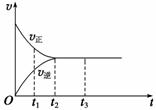
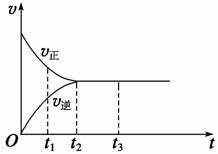 Ⅱ. (3)下图是可逆反应X2+3Y2
Ⅱ. (3)下图是可逆反应X2+3Y2 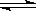 2Z在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是 。
2Z在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是 。
A.t1时,正反应速率大于逆反应速率;
B.t2时,反应达到限度;
C.t2~t3,反应不再发生;
D.t2~t3,各物质的浓度相等。
Ⅲ.以下是关于化学反应2SO2+O2 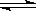 2SO3的两个素材:
2SO3的两个素材:
素材1:某温度和压强下2升容器中,不同时间点测得密闭体系中三种物质的物质的量。
|
| 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 |
| SO2 | 1 | 0.7 | 0.5 | 0.35 | 0.2 | 0.1 | 0.1 | 0.1 |
| O2 | 0.5 | 0.35 | 0.25 | 0.18 | 0.1 | 0.05 | 0.05 | 0.05 |
| SO3 | 0 | 0.3 | 0.5 | 0.65 | 0.8 | 0.9 | 0.9 | 0.9 |
素材2:反应在不同条件下进行时SO2的转化率:
(SO2的转化率是反应的SO2占起始SO2的百分数,SO2的转化率越大,化学反应的限度越大)
|
| 0.1 MPa | 0.5 MPa | 1 MPa | 10 MPa |
| 400 ℃ | 99.2 | 99.6 | 99.7 | 99.9 |
| 500 ℃ | 93.5 | 96.9 | 97.8 | 99.3 |
| 600 ℃ | 73.7 | 85.8 | 90.0 | 96.4 |
根据以上的两个素材回答问题:
(4)根据素材1中计算20~30 s期间,用二氧化硫表示的化学反应平均速率为________。
(5)根据素材2中分析得到,提高该化学反应限度的途径有:
__________________________________________________________。
(6)根据素材1、素材2中分析得到,要实现素材1中SO2的转化率需控制的反应条件是
________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
两种硫酸溶液,一种硫酸溶液的物质的量浓度为c1,密度为ρ1;另一种硫酸溶液的物质的量浓度为c2,密度为ρ2,将它们等体积混合后,所得溶液的密度为ρ3,则混合后硫酸的物质的量浓度为 ( )
A. B.
B.
C. D.
D.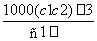
查看答案和解析>>
科目:高中化学 来源: 题型:
配制NH4Fe(SO4)2标准溶液时,加入一定量H2SO4的原因是________________;使用的仪器除天平、药匙、玻璃棒、烧杯、量筒外,还需要下图中的________(填字母代号)。

查看答案和解析>>
科目:高中化学 来源: 题型:
元素X、Y、Z原子序数之和为37,X、Y在同一周期,X+、Z-具有相同的核外电子层结构,下列推测不正确的是( )
A.同族元素中Z的氢化物稳定性最高
B.同周期元素中X的金属性最强
C.原子半径X>Y,离子半径X+>Z-
D.同周期元素中Y的最高价含氧酸的酸性最强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com