
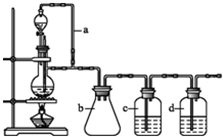

分析 (1)制备氢气选用锌粒和稀盐酸;制备丙烯选用2-丙醇和浓硫酸;
(2)在题给装置中,a的作用保持分液漏斗和烧瓶内的气压相等,以保证分液漏斗内的液体能顺利加入烧瓶中;b主要是起安全瓶的作用,以防止倒吸;
(3)若用题给装置制备H2,则不需要酒精灯,c为除去氢气中的酸性气体,选用NaOH溶液,d为除去氢气中的H2O,试剂选用浓硫酸;
(4)检验丙烯和少量SO2、CO2及水蒸气组成的混合气体各成分时,应首先选④无水CuSO4检验水蒸气,然后用②品红溶液检验SO2,并用①饱和Na2SO3溶液除去SO2;然后用②品红溶液检验SO2是否除尽,然后用③石灰水检验CO2,用⑤酸性KMnO4溶液检验丙烯;
(5)加饱和NaHSO3溶液形成沉淀,然后通过过滤即可除去;1-丁醇和乙醚的沸点相差很大,因此可以利用蒸馏将其分离开.
解答 解:(1)氢气可用活泼金属锌与非氧化性酸盐酸通过置换反应制备,氧化性酸如硝酸和浓硫酸与锌反应不能产生氢气,方程式为Zn+2HCl=ZnCl2+H2↑;2-丙醇通过消去反应即到达丙烯,方程式为:(CH3)2CHOH$\frac{\underline{\;浓H_{2}SO_{4}\;}}{△}$ CH2=CHCH3↑+H2O,
故答案为:Zn+2HCl=ZnCl2+H2↑; (CH3)2CHOH$\frac{\underline{\;浓H_{2}SO_{4}\;}}{△}$ CH2=CHCH3↑+H2O;
(2)题给装置中,a的作用保持分液漏斗和烧瓶内的气压相等,以保证分液漏斗内的液体能顺利加入烧瓶中,因为甲酸易溶于水,所以必需防止液体倒流,即b的作用是防止倒吸,
故答案为:平衡分液漏斗液面压强与圆底烧瓶内压强;防倒吸;
(3)若用以上装置制备氢气,就不再需要加热,产生的氢气中必然会混有氯化氢,所以在收集之前需要除去氯化氢,可以利用NaOH溶液吸收氯化氢,d为除去氢气中的H2O,试剂选用浓硫酸,
故答案为:NaOH溶液;浓硫酸;
(4)检验丙烯和少量SO2、CO2及水蒸气组成的混合气体各成分时,应首先选④无水CuSO4检验水蒸气,然后用②品红溶液检验SO2,并用①饱和Na2SO3溶液除去SO2;然后用②品红溶液检验SO2是否除尽,然后用③石灰水检验CO2,用⑤酸性KMnO4溶液检验丙烯,因此顺序为④②①②③⑤,
故答案为:④②①②③⑤;
(5)粗品中含有正丁醛,根据所给的信息利用加饱和NaHSO3溶液形成沉淀,然后通过过滤即可除去;由于饱和NaHSO3溶液是过量的,所以加入乙醚的目的是萃取溶液中的1-丁醇.因为1-丁醇和乙醚的沸点相差很大,因此可以利用蒸馏将其分离开.
故答案为:饱和NaHSO3溶液;过滤;萃取;蒸馏.
点评 本题考查有机物合成方案的设计,题目难度较大,综合性较强,答题时注意把握物质的分离、提纯方法,把握物质的性质的异同是解答该题的关键.


 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:选择题
| A. | 无机含氧酸分子中的氧原子数越多,则其酸性也越强 | |
| B. | 氯化银能溶于过量的氨水.是因为它与氨水反应生成了一种可溶性的配位化合物 | |
| C. | 分子是否具有极性决定分子中是否存在极性共价键 | |
| D. | 氢键就是一种存在于某些特殊含氢元素的分子中的一种化学键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
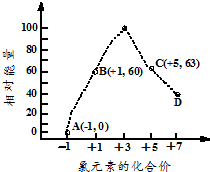 填写下列空白:
填写下列空白: .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
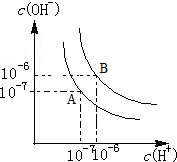 水的电离平衡如图所示.
水的电离平衡如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-1 068 kJ/mol | |
| B. | 肼是与氨类似的弱碱,它易溶于水,其电离方程式:N2H4+H2O═N2H5++OH- | |
| C. | 铂做电极,以KOH溶液为电解质溶液的肼--空气燃料电池,放电时的负极反应式:N2H4-4e-+4OH-=N2+4H2O | |
| D. | 铂做电极,以KOH溶液为电解质溶液的肼--空气燃料电池,工作一段时间后,KOH溶液的pH将增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 取代反应 | B. | 加成反应 | C. | 酯化反应 | D. | 氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 反应物 | 溴水 | 酸性KMnO4溶液 | 氢硫酸(H2S溶液) | 滴有酚酞的NaOH溶液 | 石蕊试液 | 品红溶液 |
| 反应现象 | ||||||
| SO2的性质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径的大小顺序为:rX>rY>rZ>rW>rQ | |
| B. | Z和Q形成的化合物为离子化合物 | |
| C. | 不存在由元素Z与元素W形成的化合物的水溶液 | |
| D. | 元素W的最高价氧化物对应的水化物的酸性比Q的强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com