
从海水提取溴的过程中,有如下反应: 5NaBr+NaBrO3+3H2SO4===3Br2+3Na2SO4+3H2O,与上述反应原理最相似的反应是 ( )
A.2NaBr+Cl2===Br2+2NaCl
B.AlCl3+3NaAlO2+6H2O===4Al(OH)3↓+3NaCl
C.2H2S+SO2===3S↓+2H2O
D.Cl2+H2O===HCl+HclO
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2013-2014安徽省淮南市下学期期末考试高一化学试卷(解析版) 题型:选择题
现有A、B、C、D四种金属片:
①把A、B用导线连接后同时浸入稀硫酸中,B表面变黑并逐渐溶解;
②把C、D用导线连接后同时浸入稀硫酸中,C发生氧化反应;
③把A、C用导线连接后同时浸入稀硫酸中,电子流动方向为A→导线→C。
根据上述情况,下列说法中正确的是( )
A.在①中,金属片B发生还原反应
B.在②中,金属片C作正极
C.如果把B、D用导线连接后同时浸入稀硫酸中,则金属片D上有气泡产生
D.上述四种金属的活动性由强到弱的顺序是:A>B>C>D
查看答案和解析>>
科目:高中化学 来源:2013-2014安徽省、合肥六中第二学期期末联考高二化学试卷(解析版) 题型:填空题
(7分)在一个密闭容器中,有一个左右可滑动隔板,两边分别进行可逆反应,各物质的量如下:M、N、P为2.5mol、3.0mol、1.0mol。A、C、D各为0.50mol,B的物质的量为x,当x的物质的量在一定范围内变化,均可以通过调节反应器的温度,使两侧反应均达到平衡,且隔板在反应器的正中位置。达到平衡后,测得M的转化率为75%,填写空白:

(1)达到平衡后,反应器左室气体总的物质的量为 mol。
(2)若要使右室反应开始时V正>V逆,x的取值范围 。
(3)若要使右室反应开始时V正<V逆,x的取值范围 。
查看答案和解析>>
科目:高中化学 来源:2013-2014安徽省、合肥六中第二学期期末联考高二化学试卷(解析版) 题型:选择题
某有机物X能发生水解反应,水解产物为Y和Z。同温同压下,相同质量的Y和Z的蒸气所占体积相同,化合物X可能是
A.乙酸丙酯 B.甲酸甲酯 C.乙酸甲酯 D.乙酸乙酯
查看答案和解析>>
科目:高中化学 来源:2013-2014安徽省、合肥六中第二学期期末联考高一化学试卷(解析版) 题型:选择题
“绿色化学”提倡化工生产应尽可能将反应物的原子全部利用,从根本上解决环境污染问题。在下列制备环氧乙烷的反应中,最符合“绿色化学”思想的是 ( )
A.CH2=CH2+ (过氧乙酸)
(过氧乙酸)
 +CH3COOH
+CH3COOH
B.CH2=CH2+Cl2+Ca(OH)2
 +CaCl2+H2O
+CaCl2+H2O
C.2CH2=CH2+O2 2
2
D.

 +HOCH2CH2—O—CH2CH2OH+2H2O
+HOCH2CH2—O—CH2CH2OH+2H2O
查看答案和解析>>
科目:高中化学 来源:2013-2014安徽省、合肥六中第二学期期末联考高一化学试卷(解析版) 题型:选择题
一定量的锌粉和6mol·L—1的过量盐酸反应,当向其中加入少量的下列物质:①石墨 ②CuO ③铜粉 ④锌粒 ⑤浓盐酸 ⑥无水乙酸 ⑦KNO3溶液 ⑧CuCl2时,能够加快反应速率,又不响产生H2总量的是 ( )
A.①③④ B.②④⑧ C.①③⑤ D.①⑤⑦
查看答案和解析>>
科目:高中化学 来源:2013-2014安徽省、合肥六中第二学期期末联考高一化学试卷(解析版) 题型:选择题
在下列自然资源的开发利用中,不涉及化学变化的是
A.用铁矿石冶炼铁 B.用蒸馏法淡化海水
C.用石油裂解生产乙烯 D.用煤生产水煤气
查看答案和解析>>
科目:高中化学 来源:2013-2014宁夏银川市高三第二次模拟考试理综化学试卷(解析版) 题型:填空题
(14分)
已知CO(g)+H2O(g)  CO2(g)+H2(g)反应的平衡常数和温度的关系如下:
CO2(g)+H2(g)反应的平衡常数和温度的关系如下:
|温度/ ℃ | 700 | 800 | 830 | 1000 | 1200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
(1)该反应的△H 0(填“<”“ >”“ =”);
(2)830℃时,向一个5 L的密闭容器中充入0.20mol的CO和0.80mol的H2O,反应初始6s内CO的平均反应速率v(CO)=0.003 mol·L-1·s-1,则6S末CO2的物质的量浓度为 ;反应经一段时间后,达到平衡后CO的转化率为 ;
(3)判断该反应是否达到平衡的依据为 (填正确选项前的字母);
a.压强不随时间改变 b.气体的密度不随时间改变
c.c(CO)不随时间改变 d.单位时间里生成CO和H2的物质的量相等
(4)已知1000℃时,要使CO的转化率超过90%,则起始物c(H2O): c(CO)应不低于 ;
(5)某燃料电池以CO为燃料,以空气为氧化剂,以熔融态的K2CO3为电解质,请写出该燃料电池正极的电极反应式 ;
(6)已知CO可用于制备很多物质:
 ΔH=+8.0kJ·mol-1
ΔH=+8.0kJ·mol-1
 ΔH=+90.4kJ·mol-1
ΔH=+90.4kJ·mol-1
 ΔH=-556.0kJ·mol-1
ΔH=-556.0kJ·mol-1
 ΔH=-483.6kJ·mol-1
ΔH=-483.6kJ·mol-1
请写出 与
与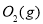 反应生成
反应生成 热化学方程式 。
热化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2013-2014宁夏高一下学期期中考试化学试卷(解析版) 题型:填空题
(10分,每空2分)按要求填下列物质。
(1)分子中含有14个氢原子的烷烃的名称是 。
(2)相对分子质量为44的烷烃的分子式为 。
(3)碳、氢原子个数比为2:5的烷烃分子式为 ,它的同分异构体的结构简式为 。
(4)含碳质量分数约为75%的烷烃的结构式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com