
| A. | 原子半径:C>Si | B. | 热稳定性:HF>HBr | C. | 还原性:S2->C1- | D. | 酸性:HNO3>H3PO4 |
分析 A.同主族从上到下原子半径增大;
B.非金属性越强,氢化物越稳定;
C.非金属性越强,对应阴离子的还原性越弱;
D.非金属性越强,最高价含氧酸的酸性越强.
解答 解:A.同主族从上到下原子半径增大,则原子半径:C<Si,故A错误;
B.非金属性F>Br,热稳定性:HF>HBr,故B正确;
C.非金属性Cl>S,对应阴离子的还原性为S2->C1-,故C正确;
D.非金属性N>P,最高价含氧酸的酸性为HNO3>H3PO4,故D正确;
故选A.
点评 本题考查元素周期律和元素周期表,为高频考点,把握元素的位置、元素的性质、元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:选择题
| A. | 单质的密度随核电荷数的增加逐渐减小 | |
| B. | 单质的颜色随核电荷数的增加而逐渐变浅 | |
| C. | 单质的氧化性随核电荷数的增加而逐渐减弱 | |
| D. | 氢化物的稳定性随核电荷数的增加逐渐增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 弱酸 | H2CO3 | 水杨酸(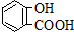 ) ) |
| 电离平衡常数(25℃) | Ka1=4.3×10-7 Ka2=5.6×10-11 | Ka1=1.3×10-3 Ka2=1.1×10-11 |
| A. | 常温下,等浓度、等体积的NaHCO3溶液pH小于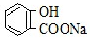 溶液pH 溶液pH | |
| B. | 常温下,等浓度、等体积的Na2CO3溶液和 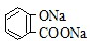 溶液中所含离子总数前者小于后者 溶液中所含离子总数前者小于后者 | |
| C. |  +2NaHCO3→ +2NaHCO3→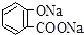 +2H2O+2CO2↑ +2H2O+2CO2↑ | |
| D. | 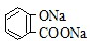 最多可与2molCO2反应 最多可与2molCO2反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
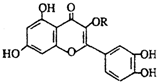 天然维生素P(结构如图)存在于槐树花蕾中,它是一种营养增补剂,关于维生素P的叙述错误的是( )
天然维生素P(结构如图)存在于槐树花蕾中,它是一种营养增补剂,关于维生素P的叙述错误的是( )| A. | 1mol天然维生素P在一定条件下最多与7molH2加成 | |
| B. | 1mol天然维生素P和溴水反应,可消耗6molBr2 | |
| C. | 可用有机溶剂萃取 | |
| D. | 1mol维生素P可以和4mol NaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制备1mol HRO3转移电子数一定为2NA | |
| B. | R、Z简单离子的还原性:Z(离子)<R(离子) | |
| C. | HZ分子的稳定性大于HR分子 | |
| D. | HRO3与HZ计量数之比为1:5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6.4gCu与足量的硫反应,转移电子数为0.2 NA | |
| B. | 通常情况下,32g O2和O3的混合气体含有的分子总数小于NA | |
| C. | 6.4g CaC2中含有的离子总数目为0.3NA | |
| D. | 标准状况下,将分子总数为NA的NH3和Cl2充分混合后,所得混合气体体积约为22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | ① | ② | ③ | |||||
| 三 | ④ | ⑤ | ⑥ | ⑦ | ||||
| 四 | ⑧ | ⑨ |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 50% | B. | 48.8% | C. | 42.1% | D. | 72.3% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com