
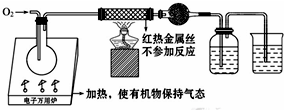
 一名同学把4.48L(已折算成标准状况下)某有机物蒸气在O2中充分燃烧,然后让产物依次通过装有无水CuSO4的干燥管、盛有浓H2SO4的洗气瓶和盛有含0.8mol Ca(OH)2的澄清石灰水的烧杯,如图所示:
一名同学把4.48L(已折算成标准状况下)某有机物蒸气在O2中充分燃烧,然后让产物依次通过装有无水CuSO4的干燥管、盛有浓H2SO4的洗气瓶和盛有含0.8mol Ca(OH)2的澄清石灰水的烧杯,如图所示: .
.| 物质种类 | 实例(写结构简式) |
分析 (1)该反应需要通过测量燃烧产物二氧化碳、水的量确定其分子式,所以需要通入过量氧气,确保有机物完全燃烧,且利用氧气将燃烧产物赶出;
(2)根据n=$\frac{V}{{V}_{m}}$计算出该有机物的物质的量,干燥管和洗气瓶共增重18g,根据n=$\frac{m}{M}$计算出水的物质的量,再利用质量守恒定律确定有机物分子中含有H原子数;澄清石灰水吸收二氧化碳,变浑浊后又恰好变澄清,说明反应生成碳酸氢钙,根据氢氧化钙的物质的量计算出消耗二氧化碳的物质的量,再计算出该有机物分子中含有的C原子数,从而确定该有机物的分子式;不含任何官能团,也不含脂环,该有机物可能含有苯环;
(3)结合(2)分析,若该有机物分子中含有一个氧原子,可能为醇、酚、或醚等.
解答 解:(1)试验过程中,为了把有机物蒸气完全带入反应装置,保证有机物完全燃烧,从反应装置中把H2O(g)和CO2完全赶出,所以通入的氧气需要足量,
故答案为:把有机物蒸气完全带入反应装置;保证有机物完全燃烧;从反应装置中把H2O(g)和CO2完全赶出;
(2)标准状况下4.48L气体的物质的量为:$\frac{4.48L}{22.4L/mol}$=0.2mol,
无水CuSO4变蓝,干燥管和洗气瓶共增重18g,说明18g为水的质量,则水的物质的量为:$\frac{18g}{18g/mol}$=1mol,该有机物分子中含有H原子数为:$\frac{1mol×2}{0.2mol}$=10,
含0.8mol Ca(OH)2的澄清石灰水变浑浊又变澄清,说明二氧化碳与氢氧化钙反应生成碳酸氢钙,则生成二氧化碳的物质的量为:0.8mol×2=1.6mol,该有机物分子中含有C原子数为:$\frac{1.6mol}{0.2mol}$=8,
该有机物只含C、H元素,则该有机物分子式为:C8H10,该有机物不含任何官能团,但含苯环,则该有机物属于苯的同系物、芳香烃,可能为 ,
,
故答案为:C8H10;B C; ;
;
(3)若该有机物分子中含有一个氧原子,则分子式为C8H10O,可能为醇,如苯乙醇,可能为酚,如乙基苯酚,可能为醚,如苯甲醚等,如表所示: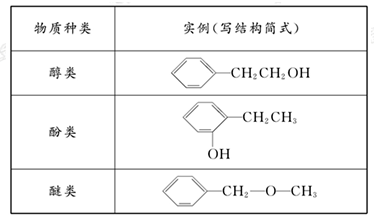 ,
,
故答案为: .
.
点评 本题考查了有机物的推断,为高考常见题型,侧重于学生的分析、计算能力的考查,注意把握分子式的确定方法,题目难度中等,明确质量守恒定律在确定有机物分子式中的应用,注意掌握常见有机物结构、性质及分类方法.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验序号 | ① | ② | ③ | ④ |
| 盐酸体积/mL | 50 | 50 | 50 | 50 |
| 固体质量/g | 3.06 | 6.12 | 9.18 | 12.24 |
| 生成气体体积/L(标况) | 0.672 | 1.344 | 1.568 | 1.344 |
| A. | 实验②中,混合物过量 | |
| B. | 原混合物样品中 n(Na2CO3):n(KHCO3)=1:1 | |
| C. | 盐酸的物质的量浓度为 2 mol•L-1 | |
| D. | 实验④反应后,至少需继续加入 40ml 的该盐酸溶液才能把12.24g的混合物全部反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 至少存在5 种离子 | |
| B. | SO42-、NH4+、Fe3+、一定存在,Cl-、K+、Al3+可能存在 | |
| C. | K+一定存在,Al3+可能存在 | |
| D. | Cl-一定存在,且c(Cl-)≥0.4mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 产品标准 | GB5461 |
| 产品等级 | 一级 |
| 配料 | 食盐、碘酸钾、抗结剂 |
| 碘含量(以I计) | 20~50mg/kg |
| 分装日期 | |
| 分装企业 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 20gD2O和18gH2O中含有的质子数均为10NA | |
| B. | 2L0.5mol/L亚硫酸溶液中含有的H+数为2NA | |
| C. | 标准状况下,22.4L水中含有共价键数为2NA | |
| D. | 50mL 12mol/L盐酸与足量MnO2共热,转移的电子数为0.3NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com