
| A、SiO2、P2O5均能溶解在NaOH溶液中反应生成盐和水 |
| B、CuS,CaC2,Na2O2均能与稀硫酸反应产生气体 |
| C、F,Cl,Br,I的单质和氢化物的沸点随原子序数的增大而升高 |
| D、Li,Na,Mg,Al的最高价氧化物对应水化物的碱性逐渐减低 |


 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:
| A、将氯气通入水中:Cl2+H2O=2H++Cl-+ClO- |
| B、在铁粉中加入硫酸铁溶液:Fe3++Fe=2Fe2+ |
| C、氧化铜溶于稀硝酸:CuO+2H+=Cu2++H2O |
| D、小苏打与氢氧化钠两种溶液混合:HCO3-+OH-=CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将106gNa2CO3溶于100mL水中 |
| B、含3molO的硝酸溶于水得100mL溶液 |
| C、从2L物质的量浓度为1mol/L的NaCl溶液中取出100mL溶液 |
| D、22.4LHCl气体溶于水得1L溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②④ | B、②③④ |
| C、①③④ | D、④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
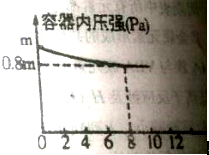
查看答案和解析>>
科目:高中化学 来源: 题型:

| NaOH/H2O |
| H+ |
| Fe/HCl |

查看答案和解析>>
科目:高中化学 来源: 题型:
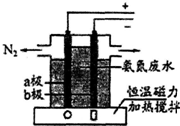 利用合成氨生产尿素[CO(NH2)2]是重要的化学工艺.在3个2L的密闭容器中,使用相同的催化剂,按不同方式投入反应物,分别进行反应:3H2(g)+N2(g)?2NH3(g).保持恒温、恒容,测得反应达到平衡时有关数据如下:
利用合成氨生产尿素[CO(NH2)2]是重要的化学工艺.在3个2L的密闭容器中,使用相同的催化剂,按不同方式投入反应物,分别进行反应:3H2(g)+N2(g)?2NH3(g).保持恒温、恒容,测得反应达到平衡时有关数据如下:| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 3mol H2、2mol N2 | 6mol H2、4molN2 | 2molNH3 |
| 达到平衡的时间/min | 5 | 8 | |
| 平衡时N2的浓度/mol?L-1 | c1 | 1.5 | |
| NH3的体积分数 | ω1 | ω3 | |
| 混合气体密度/g?L-1 | ρ1 | ρ2 | |
| 平衡常数/L2?mol-2 | K甲 | K乙 | K丙 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com