
| A. | Al2O3可用作耐火材料 | |
| B. | Al(OH3)可用于中和胃酸过多 | |
| C. | Na2O2可用于呼吸面具和潜艇中作氧气的来源 | |
| D. | NaHCO3的水溶液呈碱性,因此NaHCO3不能用作食品添加剂 |
分析 A、Al2O3的熔点高,可作耐高温材料;
B、根据氢氧化铝与盐酸反应分析;
C、过氧化钠与二氧化碳反应生成氧气,根据反应的方程式为2Na2O2+2H2O=4NaOH+O2↑判断;
D、碳酸氢钠可以作食品的疏松剂.
解答 解:A、Al2O3的熔点高,可作耐高温材料,故A正确;
B、因为氢氧化铝与盐酸反应,所以Al(OH)3用于治疗胃酸过多,故B正确;
C、因发生2Na2O2+2CO2=2Na2CO3+O2,则过氧化钠可用于呼吸面具中作为氧气的来源,故C正确;
D、碳酸氢钠可以作食品的疏松剂,可用作食品添加剂,故D错误;
故选D.
点评 本题主要考查了氢氧化铝和氧化铝的性质和用途,主要是常见物质在生产生活中的具体用途、常见物质的制备及发生的化学反应方程式等方面的知识,题目较简单.


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:填空题
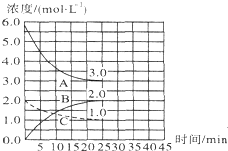 目前工业合成氨的原理是N2(g)+3H2(g)?2NH3(g)△H=-93.0kJ•mol-1
目前工业合成氨的原理是N2(g)+3H2(g)?2NH3(g)△H=-93.0kJ•mol-1查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L 0.1 mol•L-1的Al2(SO4)3溶液中,Al3+的数目为0.2 NA | |
| B. | 常温下,2.24LCl2完全与NaOH溶液反应,转移的电子数目一定为0.1 NA | |
| C. | 7.8g由Na2S和Na2O2组成的混合物中含有阴离子的数目为 0.1NA | |
| D. | 1L 0.1mol•L-1的NaHCO3溶液中HCO3-和CO32-离子数之和为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去苏打中混有的小苏打杂质;分离氯化钠固体中混有的碘单质 | |
| B. | 除去粗食盐中的泥沙;除去氯化钾中的二氧化锰 | |
| C. | 分离硝酸钾与氯化钠;除去氢氧化铁胶体中混有的氯化钠 | |
| D. | 除去二氧化碳中混有的少量二氧化硫;除去二氧化碳中混有的少量一氧化碳 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子总数为NA的NO2和CO2混合气体中含有的氧原子数为2NA | |
| B. | 常温常压下,0.1mol铁在0.1molC12中充分燃烧,转移的电子数为0.3NA | |
| C. | 0.1mol/L的K2CO3溶液中CO32-数小于0.1NA | |
| D. |  0.5mol雄黄(As4S4,结构如图)含有NA个S-S键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
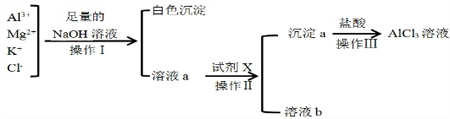 某校化学兴趣小组用如图所示过程除去AlCl3溶液中含有的Mg2+、K+杂质离子并尽可能减少AlCl3的损失
某校化学兴趣小组用如图所示过程除去AlCl3溶液中含有的Mg2+、K+杂质离子并尽可能减少AlCl3的损失查看答案和解析>>
科目:高中化学 来源: 题型:解答题
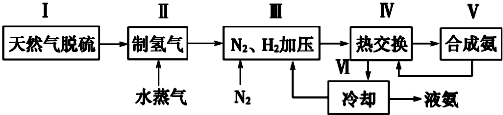
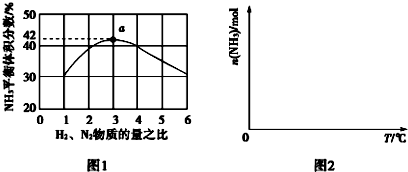
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com