
【题目】在一定体积pH=12的Ba(OH)2溶液中,逐滴加入一定物质的量浓度的NaHSO4溶液,当溶液中的Ba2+恰好完全沉淀时,溶液pH=11.若反应后溶液的体积等于Ba(OH)2溶液与NaHSO4溶液的体积之和,则Ba(OH)2溶液与NaHSO4溶液体积比是( )
A.1: 9
B.1:1
C.1:2
D.1:4
科目:高中化学 来源: 题型:
【题目】3,5﹣二甲氧基苯酚是重要的有机合成中间体,可用于天然物质白柠檬素的合成.一种以间苯三酚为原料的合成反应如下: 
甲醇、乙醚和3,5﹣二甲氧基苯酚的部分物理性质见表:
物质 | 沸点/℃ | 熔点/℃ | 密度(20℃)/gcm﹣3 | 溶解性 |
甲醇 | 64.7 | / | 0.7915 | 易溶于水 |
乙醚 | 34.5 | / | 0.7138 | 微溶于水 |
3,5﹣二甲氧基苯酚 | / | 33﹣36 | / | 易溶于甲醇、乙醚,微溶于水 |
反应结束后,先分离出甲醇,再加入乙醚进行萃取.
(1)①分离出甲醇的操作是 .
②萃取用到的分液漏斗使用前需并洗净,分液时有机层在分液漏斗的填(“上”或“下”)层.
(2)分离得到的有机层依次用饱和NaHCO3溶液、饱和食盐水、少量蒸馏水进行洗涤.用饱和NaHCO3 溶液洗涤的目的是;用饱和食盐水洗涤的目的是 .
(3)洗涤完成后,通过以下操作分离、提纯产物,正确的操作顺序是(填字母).
a.蒸馏除去乙醚 b.重结晶 c.过滤除去干燥剂 d.加入无水CaCl2干燥.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度和压强下,10 L气体A2跟20 L气体B2化合生成20 L某气体C,则气体C化学式为 ( )
A. AB2 B. A2B C. AB3 D. AB
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】教材中用酸性KMnO4溶液和H2C2O4(草酸)反应研究影响反应速率的因素,离子方程式为:2MnO4﹣+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O.一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如图一和表: 
实验序号 | A溶液 | B溶液 |
① | 20 mL 0.1 molL﹣1H2C2O4溶液 | 30 mL 0.01 molL﹣1kMnO4溶液 |
② | 20 mL 0.2 molL﹣1 | 30 mL 0.01 molL﹣1KMnO4溶液 |
(1)用电离方程式表示草酸溶液显酸性的原因
(2)该实验探究的是因素对化学反应速率的影响.相同时间内针筒中所得CO2的体积大小关系是①②(填“>”“<”“=”)
(3)若实验①在2min末收集了896mL CO2(标准状况下),则用MnO4﹣表示该时间内的化学反应速率为v (MnO4﹣)= .
(4)除通过测定一定时间内CO2的体积来比较反应速率,本实验还可通过测定来比较化学反应速率.
(5)该实验小组同学发现反应速率如图二所示,其中t1~t2时间内速率变快的主要原因可能是:①该反应放热、② .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下图所示装置进行下列实验,实验结果与预测的现象不一致的是

选项 | ①中的物质 | ②中的物质 | 预测装置中现象 |
A | NO2 | 蒸馏水 | 试管充满无色溶液 |
B | SO2 | 紫色石蕊溶液 | 溶液逐渐变为红色 |
C | NH3 | AlCl3溶液 | 产生白色沉淀 |
D | Cl2 | AgNO3溶液 | 产生白色沉淀 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学知识填写下列空白.
(1)有机物 ![]() 的系统名称是 , 将其在催化剂存在下完全氢化,所得烷烃的系统名称是 . 该烷烃的一氯代物最多有种.
的系统名称是 , 将其在催化剂存在下完全氢化,所得烷烃的系统名称是 . 该烷烃的一氯代物最多有种.
(2)2,3﹣二甲基﹣4﹣乙基已烷结构简式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
工业上常利用含硫废水生产Na2S2O3 ·5H2O,某小组同学用如下装置(略去部分夹持仪器,气密性已检验)模拟生产过程。实验步骤是:先向C中烧瓶加入Na2S和Na2SO3混合溶液,再向A中烧瓶滴加浓H2SO4;待Na2S和Na2SO3完全消耗后,过滤C中混合物,滤液经结晶即得到产品。

已知:i.烧瓶C中发生反应如下:
Na2S(aq)+H2O(l)+SO2(g)===Na2SO3(aq)+H2S(aq) (a)
2H2S(aq)+SO2(g)===3S(s)+2H2O(l)(b)
S(s)+Na2SO3(aq) ![]() Na2S2O3(aq) (c)
Na2S2O3(aq) (c)
ii.BaS2O3易溶于水。
(1)E中的试剂是__________。
(2)为提高产品纯度,应使烧瓶C中Na2S和Na2SO3恰好完全反应,则烧瓶C中Na2S和Na2SO3物质的量之比为__________。
(3)已知反应(c)相对较慢,则烧瓶C中反应达到终点的现象是__________。
(4)产品中常含有Na2SO3和Na2SO4。该小组设计了以下实验方案进行检验。
步骤 | 实验操作 | 实验现象 |
Ⅰ | 取适量产品配成稀溶液,滴加足量BaCl2溶液 | 有白色沉淀生成 |
Ⅱ | 过滤,用蒸馏水洗涤沉淀,向沉淀中加入足量__________ | 沉淀未完全溶解,并有刺激性气味的气体产生 |
①步骤Ⅱ中加入的试剂可以是__________(填序号)。
A.稀硫酸 B.稀盐酸 C.稀硝酸 D.氢氧化钠溶液
②步骤Ⅱ设计过滤操作的目的是(用化学方程式简要文字表述)__________。
(5)为减少装置C中生成的Na2SO4的量,在不改变原有装置的基础上对原实验步骤进行了改进,改进后的操作是__________。
(6)Na2S2O3常用作脱氯剂。Na2S2O3溶液与Cl2反应的离子方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向体积均为10 mL、物质的量浓度相同的两份NaOH 溶液中分别通入一定量的CO2,得到溶液甲和乙。向甲、乙两溶液中分别滴加0.1mol/L的盐酸,此时反应生成CO2体积(标准状况)与所加盐酸体积的关系如图所示。则下列叙述中不正确的是
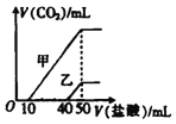
A. 原NaOH溶液的物质的量浓度为0.5 mol/L
B. 当0盐酸)<10 mL时,甲溶液中发生反应的离子方程式为H++CO32-=HCO3-
C. 乙溶液中含有的溶质是Na2CO3、NaOH
D. 向乙溶液中滴加过量盐酸后产生CO2体积的最大值为224 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2气体为无色气体,有强烈刺激性气味,大气主要污染物之一,某学习小组为了探究二氧化硫的某些性质,进行了如下实验。
I.如下图所示,使用药品和装置一探究二氧化硫的还原性:
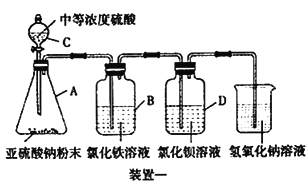
(1)装置C的名称为________。
(2)B中溶液的现象为________。
(3)学生甲预测装置D 中没有白色沉淀产生,但随着反应的进行,发现D 中产生了少量白色沉淀。学生乙经过查阅资料发现少量白色沉淀可能是硫酸钡,因为装置或溶液中少量的氧气参与了氧化反应,请写出装置D 中的反应方程式________。
II.经过思考,设计了如下装置二,且所配制的溶液均使用无氧蒸馏水,检验SO2 在无氧干扰时,是否与氯化钡反应生成沉淀。
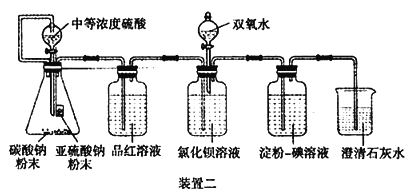
(4)碳酸钠粉末的目的是________。
(5)当______时,氯化钡溶液中没有沉淀出现,说明二氧化硫不与氯化钡溶液反应,此时滴加双氧水,出现了白色沉淀。
(6)裝置二选用澄清石灰水而不用氢氧化钠溶液的目的是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com