
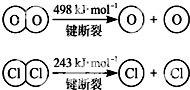
 用Cl2生产某些含氯有机物时会产生副产物HCl.利用反应4HCl+O2═2Cl2+2H2O可实现氯的循环利用.已知:该反应中,4mol HCl被氧化,放出115.6kJ的热量.
用Cl2生产某些含氯有机物时会产生副产物HCl.利用反应4HCl+O2═2Cl2+2H2O可实现氯的循环利用.已知:该反应中,4mol HCl被氧化,放出115.6kJ的热量. ,
, ;
;

 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:
| 题号 | 是否合理 | 理 由 |
| (1) | ||
| (2) | ||
| (3) | ||
| (4) | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 20世纪30年代,Eyring和Pelzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量过渡态.
20世纪30年代,Eyring和Pelzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量过渡态.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 单质硼有无定形和晶体两种,参考下列数据
单质硼有无定形和晶体两种,参考下列数据| 金刚石 | 晶体硅 | 晶体硼 | |
| 熔点/K | >3550 | 1410 | 2573 |
| 沸点/K | 4827 | 2628 | 2823 |
| 摩氏硬度 | 10 | 6.5 | 9.5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com