
| A. | Cu与石墨都能导电,但都属于非电解质 | |
| B. | AgCl与BaSO4都是难溶性盐,但都属于强电解质 | |
| C. | SO2与CaO都是氧化物,因此SO2、CaO都是非电解质 | |
| D. | NaCl与HCl都是电解质,因此熔融NaCl、液态HCl都能导电 |
分析 电解质:在水溶液中或熔融状态下能导电的化合物;例:酸、碱、盐,金属氧化物等.
非电解质:在水溶液中或熔融状态下不能导电的化合物;例:有机物,非金属氧化物等,完全电离的属于强电解质,部分电离的属于弱电解质,据此解答即可.
解答 解:A.Cu与石墨均是单质,既不是电解质也不是非电解质,故A错误;
B.AgCl与BaSO4都是难溶性盐,在熔化状态下均能完全电离,属于强电解质,故B正确;
C.CaO为金属氧化物,熔融状态下能电离,属于电解质,故C错误;
D.液态的HCl不能电离,不能导电,故D错误,故选B.
点评 本题主要考查的是电解质与非电解质的概念,强弱电解质的概念,难度不大,掌握HCl液态状态不能导电,此为易错点.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 1.0L 1.0mo1•L-1的NaAlO2水溶液中含有的氧原子数为2NA | |
| B. | 常温常压下,8gO2含有4NA个电子 | |
| C. | 25℃时pH=13的NaOH溶液中含有OH-的数目为0.1NA | |
| D. | 1mol的羟基与1mol的氢氧根离子所含电子数均为9NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A原子的主族序数比B原子的主族序数大 | |
| B. | A原子的周期序数B原子的周期序数大 | |
| C. | 1mol A 与酸反应置换出的H2比1 mol B与酸反应置换出的H2多 | |
| D. | 把AB用导线连接后放入盛有稀硫酸的烧杯中,B上产生气泡 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 920 kJ | B. | 557 kJ | C. | 436 kJ | D. | 188 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
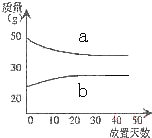
| A. | a挥发、b吸水 | B. | a升华、b冷凝 | C. | a蒸发、b潮解 | D. | a冷凝、b吸水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:D>E>B>C>A | |
| B. | 热稳定性:EA4<A2C | |
| C. | B元素的最高价氧化物的水化物与D单质反应不能生成A2气体 | |
| D. | 化合物DC与化合物EC2中化学键类型相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al3+Na+HCO3- Cl- | B. | K+ Na+ HCO3-AlO2- | ||
| C. | Mg2+ NH4+ SO42-Cl- | D. | Fe2+ Na+Cl- NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com