
 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
下列说法不正确的是
A.已知冰的熔化热为6.0 kJ/mol,冰中氢键键能为20 kJ/mol,假设1 mol冰中有2 mol 氢键,且熔化热完全用于破坏冰的氢键,则最多只能破坏冰中15%的氢键
B.已知一定温度下,醋酸溶液的物质的量浓度为c,电离度为α,![]() 。
。
若加入少量醋酸钠固体,则CH3COOH![]() CH3COO-+H+向左移动,α减小,Ka变小
CH3COO-+H+向左移动,α减小,Ka变小
C.实验测得环己烷(l)、环己烯(l)和苯(l)的标准燃烧热分别为-3916 kJ/mol、-3747 kJ/mol和-3265 kJ/mol,可以证明在苯分子中不存在独立的碳碳双键
D.已知:Fe2O3(s)+3C(石墨)![]() 2Fe(s)+3CO(g),△H=+489.0 kJ/mol。
2Fe(s)+3CO(g),△H=+489.0 kJ/mol。
CO(g)+![]() O2(g)
O2(g)![]() CO2(g),△H=-283.0 kJ/mol。
CO2(g),△H=-283.0 kJ/mol。
C(石墨)+O2(g)![]() CO2(g),△H=-393.5 kJ/mol。
CO2(g),△H=-393.5 kJ/mol。
则4Fe(s)+3O2(g)![]() 2Fe2O3(s),△H=-1641.0 kJ/mol
2Fe2O3(s),△H=-1641.0 kJ/mol
查看答案和解析>>
科目:高中化学 来源:2012-2013学年云南省玉溪一中高二上学期期末考试化学试卷(带解析) 题型:填空题
(每空2分,共6分)热化学方程式中的ΔH实际上是热力学中的一个物理量,叫做焓变,其数值和符号与反应物和生成物的总能量有关,也与反应物和生成物的键能有关。
(1)如下图Ⅰ所示表示的是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:________________________。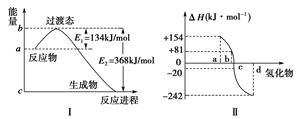
(2)图Ⅱ表示氧族元素中的氧、硫、硒、碲在生成氢化物时的焓变数据,根据焓变数据可确定a、b、c、d分别代表哪种元素,试写出硒化氢在热力学标准态下,发生分解反应的热化学方程式:_________________________________________________。
(3)已知:
①Fe2O3(s)+3CO(g)===2Fe(s)+3CO2(g);
ΔH=-25 kJ·mol-1,
②3Fe2O3(s)+CO(g)===2Fe3O4(s)+CO2(g);
ΔH=-47 kJ·mol-1,
③Fe3O4(s)+CO(g)===3FeO(s)+CO2(g);
ΔH=19 kJ·mol-1
请写出CO还原FeO的热化学方程式:
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2014届江苏省宿迁市高三上学期第一次摸底考试化学试卷(解析版) 题型:填空题
研究CO2的利用对促进低碳社会的构建具有重要意义。
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等。
已知:Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) △H 1=+489.0 kJ·mol-1
C(石墨)+CO2(g)=2CO(g) △H 2=+172.5 kJ·mol-1
则CO还原Fe2O3(s)的热化学方程式为 。
(2)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为:
CO2(g)+3H2(g) CH3OH(g)+H2O(g)
△H
CH3OH(g)+H2O(g)
△H
①该反应的平衡常数表达式为K= 。
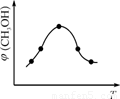
②取一定体积CO2和H2的混合气体(物质的量之比为1∶3),加入恒容密闭容器中,发生上述反应。反应过程中测得甲醇的体积分数φ(CH3OH)与反应温度T的关系如图所示,则该反应的ΔH 0(填“>”、“<”或“=”)。
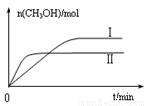
③在两种不同条件下发生反应,测得CH3OH的物质的量随时间变化如图所示,曲线I、Ⅱ对应的平衡常数大小关系为KⅠ KⅡ(填“>”、“<”或“=”)。
(3)以CO2为原料还可以合成多种物质。
①工业上尿素[CO(NH2)2]由CO2和NH3在一定条件下合成,其反应方程式为 。当氨碳比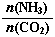 =3,达平衡时CO2的转化率为60%,则NH3的平衡转化率为
=3,达平衡时CO2的转化率为60%,则NH3的平衡转化率为
。
②用硫酸溶液作电解质进行电解,CO2在电极上可转化为甲烷,该电极反应的方程式为 。
查看答案和解析>>
科目:高中化学 来源:2013届浙江宁波金兰合作组织高二下学期期中联考化学试卷(解析版) 题型:选择题
下列说法不正确的是
A.已知冰的熔化热为6.0 kJ/mol,冰中氢键键能为20 kJ/mol,假设1 mol冰中有2 mol 氢键,且熔化热完全用于破坏冰的氢键,则最多只能破坏冰中15%的氢键
B.已知一定温度下,醋酸溶液的物质的量浓度为c,电离度为α,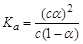 。若加入少量醋酸钠固体,则CH3COOH
。若加入少量醋酸钠固体,则CH3COOH CH3COO-+H+向左移动,α减小,Ka变小
CH3COO-+H+向左移动,α减小,Ka变小
C.实验测得环己烷(l)、环己烯(l)和苯(l)的标准燃烧热分别为-3916 kJ/mol、-3747 kJ/mol和-3265 kJ/mol,可以证明在苯分子中不存在独立的碳碳双键
D.已知:Fe2O3(s)+3C(石墨) 2Fe(s)+3CO(g),△H=+489.0 kJ/mol。
2Fe(s)+3CO(g),△H=+489.0 kJ/mol。
CO(g)+1/2O2(g) CO2(g),△H=-283.0 kJ/mol。
CO2(g),△H=-283.0 kJ/mol。
C(石墨)+O2(g) CO2(g),△H=-393.5 kJ/mol。
CO2(g),△H=-393.5 kJ/mol。
则4Fe(s)+3O2(g) 2Fe2O3(s),△H=-1641.0 kJ/mol
2Fe2O3(s),△H=-1641.0 kJ/mol
查看答案和解析>>
科目:高中化学 来源:2010-2011学年广东省中山市实验高中高三12月月考(理综)化学部分 题型:选择题
已知:Fe2O3 (s)+C(s)= CO2(g)+2Fe(s) △H=234.1kJ·mol-1
C(s)+O2(g)=CO2(g) △H=-393.5kJ·mol-1 则2Fe(s)+O2(g ) = Fe2O3(s) 的△H是
A.-824.4kJ·mol-1 B.-627.6kJ·mol-1
C.-744.7kJ·mol-1 D.-169.4kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com