
【题目】氟是一种非金属性极强的元素,它的单质甚至能与稀有气体氙反应生成XeF2、XeF4、XeF6等固体,这些固体都极易与水反应。试回答下列问题:
(1)已知XeF4与H2O反应的化学反应方程式为:6XeF4+12H2O=4Xe↑+3O2↑+2XeO3+24HF,该反应中1molH2O可以还原__________molXeF4。
(2)已知XeF6与H2O发生非氧化还原反应而完全水解(XeF6+3H2O=XeO3+6HF)。现有14.7gXeF6完全水解后,再加入100mL0.600mol·L-1Mn2+的水溶液恰好完全反应,放出的气体干燥后再通过红热的金属铜,气体体积减少20%。
①通过计算可确定Mn2+的氧化产物为_________________离子;
②已知氢氟酸溶液中存在电离平衡,其含氟各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH 的关系如图所示,图中a 点pH=-lg(4.0×10-4)。

写出氢氟酸的电离平衡常数Ka的数学表达式_________________,将上述(2)中所得溶液稀释到1000mL(不考虑稀释对氢氟酸电离平衡的影响),则稀释后溶液中。H+浓度约为__________ mol·L-1,F-浓度约为__________ mol·L-1。
(3)若先向FeCl3溶液中加入足量NaF溶液,再滴加KSCN溶液,不呈红色,若再加入足够量FeCl3溶液,呈现红色。请对上述实验现象作出解释____________________________。
【答案】 0.5 MnO4- Ka= 0.18 8.0
0.18 8.0![]() 10-4 加入足量NaF溶液,F-与Fe3+反应生成更为稳定的无色物质(FeF63-),当再加入足量的FeCl3溶液时,溶液又呈血红色,说明SCN-没有被消耗
10-4 加入足量NaF溶液,F-与Fe3+反应生成更为稳定的无色物质(FeF63-),当再加入足量的FeCl3溶液时,溶液又呈血红色,说明SCN-没有被消耗
【解析】(1)反应6XeF4+12H2O=4Xe↑+3O2↑+2XeO3+24HF中,Xe元素化合价由+4价变为0价和+6价,O元素化合价由-2价变为0价,该反应中![]() 的XeF4作氧化剂,
的XeF4作氧化剂, ![]() 的XeF4作还原剂,
的XeF4作还原剂, ![]() 的H2O作还原剂,若12molH2O参与反应,则有6molH2O作还原剂,参与反应的XeF4有6mol,其中做为氧化剂量的有
的H2O作还原剂,若12molH2O参与反应,则有6molH2O作还原剂,参与反应的XeF4有6mol,其中做为氧化剂量的有![]() mol,被XeF4还原的XeF4有
mol,被XeF4还原的XeF4有![]() mol,被H2O还原的XeF4有
mol,被H2O还原的XeF4有![]() mol,故反应中1molH2O可以还原
mol,故反应中1molH2O可以还原![]() molXeF4;(2) ①14.7gXeF6为0.06mol,生成XeO3为0.06mol,共放出Xe气体0.06mol,被铜吸收的O2为
molXeF4;(2) ①14.7gXeF6为0.06mol,生成XeO3为0.06mol,共放出Xe气体0.06mol,被铜吸收的O2为![]() =0.015mol,由此可知发生反应的XeO3为0.01mol,氧化Mn2+的XeO3为0.05mol,Mn2+为0.06mol,设Mn2+的氧化产物的化合价为x ,则0.05mol×6=0.06mol×(x-2),解得x=+7,则应为MnO4-;②氢氟酸的电离平衡常数Ka的数学表达式为:Ka=
=0.015mol,由此可知发生反应的XeO3为0.01mol,氧化Mn2+的XeO3为0.05mol,Mn2+为0.06mol,设Mn2+的氧化产物的化合价为x ,则0.05mol×6=0.06mol×(x-2),解得x=+7,则应为MnO4-;②氢氟酸的电离平衡常数Ka的数学表达式为:Ka= ;
;
②图中a点pH=-lg(4.0×10-4),c(H+)=4.0×10-4mol/L, c(HF)= c(F-),:Ka= = c(H+)=4.0×10-4mol/L,n(XeF6)=
= c(H+)=4.0×10-4mol/L,n(XeF6)=![]() =0.06mol,所得溶液稀释到1000mL后,
=0.06mol,所得溶液稀释到1000mL后,
由XeF6+ 3H2O= XeO3 + 6HF
0.06mol 0.06mol 0.36mol
再由4XeO3+4Mn2++6H2O=4Xe+4MnO4-+O2↑+12H+
0.06mol 0.18mol
c(H+)=0.18mol/L,则c(F-)= =
=![]() =8.0×10-4mol/L;(3)若先往FeCl3溶液中加入足量NaF溶液,再滴加KSCN溶液,则不呈红色,说明溶液中没有Fe3+,即F-与Fe3+反应生成更为稳定的无色FeF63-,当再加入足量的FeCl3溶液时,溶液又呈血红色,说明SCN-没有被消耗。
=8.0×10-4mol/L;(3)若先往FeCl3溶液中加入足量NaF溶液,再滴加KSCN溶液,则不呈红色,说明溶液中没有Fe3+,即F-与Fe3+反应生成更为稳定的无色FeF63-,当再加入足量的FeCl3溶液时,溶液又呈血红色,说明SCN-没有被消耗。


 天天向上口算本系列答案
天天向上口算本系列答案科目:高中化学 来源: 题型:
【题目】下图是立方烷(cubane)的球棍模型,下列有关说法不正确的是
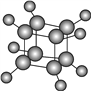
A. 其一氯代物只有一种
B. 其二氯代物有三种
C. 立方烷是乙烷的同系物
D. 它与苯乙烯(C6H5—CH=CH2)互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示是由4个碳原子结合成的4种烃(氢原子没有画出)。

(1)写出有机物(a)的习惯命名法的名称:________。
(2)上述有机物中,分子中碳原子一定在同一平面的是______________、______________(填结构简式)。
(3)上述有机物中不能与溴水发生反应使其褪色的有______(填字母代号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列有关叙述正确的是
A. 标准状况下,2.24 L![]() 中含有碳碳双键数为0.3NA
中含有碳碳双键数为0.3NA
B. 0.1mol甲烷和乙烯组成的混合气体完全燃烧,生成的水分子数为0.2NA
C. 0.1molCH4与0.1molCl2混合充分光照,生成CH3Cl分子数为0.1 NA
D. 0.1molN2和0.3molH2在高温、高压及催化剂下充分反应,产物的分子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝分别与足量的稀盐酸和氢氧化钠溶液反应时,当两个反应放出的气体在相同状况下体积相等时,反应中消耗的盐酸和氢氧化钠的物质的量之比为( )
A. 1∶1 B. 2∶1 C. 3∶1 D. 1∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述一定正确的是
A. 2.0gH218O和D2O的混合物中含有质子数为NA
B. 1.0L2.0mol/LNaOH溶液中含有氧原子数为2NA
C. 3.4gH2O2参加氧化还原反应时转移电子数为0.1 NA
D. 标准状况下2.24L的CCl4含有共价键数目为0.4 NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com