
(13分)工业上生产高氯酸时,还同时生产了一种常见的重要含氯消毒剂和漂白剂
亚氯酸钠(NaClO2),其工艺流程如下: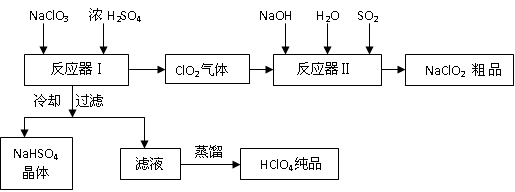
已知:
1.NaHSO4溶解度随温度的升高而增大,适当条件下可结晶析出。
2.高氯酸是至今为止人们已知酸中的最强酸,沸点90℃。
请回答下列问题
(1)反应器Ⅰ中发生反应的化学方程式为 ,冷却的目的是 ,能用蒸馏法分离出高氯酸的原因是 。
(2)反应器Ⅱ中发生反应的离子方程式为 。
(3)通入反应器Ⅱ中的SO2用另一物质H2O2代替同样能生成 NaClO2 ,请简要说明双氧水在反应中能代替SO2的原因是
(4)Ca(ClO)2 、ClO2、NaClO、NaClO2 等含氯化合物都是常用的消毒剂和漂白剂是因为它们都具有 请写出工业上用氯气和NaOH溶液生产另一种消毒剂 NaClO的离子方程式
科目:高中化学 来源: 题型:
 工业上生产高氯酸(沸点:90°C)时还同时生产了亚氯酸钠,其工艺流程如下:
工业上生产高氯酸(沸点:90°C)时还同时生产了亚氯酸钠,其工艺流程如下:查看答案和解析>>
科目:高中化学 来源: 题型:
(13分)工业上生产高氯酸时,还同时生产了一种常见的重要含氯消毒剂和漂白剂
亚氯酸钠(NaClO2),其工艺流程如下:
已知:
1.NaHSO4溶解度随温度的升高而增大,适当条件下可结晶析出。
2.高氯酸是至今为止人们已知酸中的最强酸,沸点90℃。
请回答下列问题
(1)反应器Ⅰ中发生反应的化学方程式为 ,冷却的目的是 ,能用蒸馏法分离出高氯酸的原因是 。
(2)反应器Ⅱ中发生反应的离子方程式为 。
(3)通入反应器Ⅱ中的SO2 用另一物质H2O2代替同样能生成 NaClO2,请简要说明双氧水在反应中能代替SO2 的原因是
(4)Ca(ClO)2、ClO2、NaClO、NaClO2 等含氯化合物都是常用的消毒剂和漂白剂是因为它们都具有 请写出工业上用氯气和NaOH溶液生产另一种消毒剂 NaClO的离子方程式
查看答案和解析>>
科目:高中化学 来源:2011届广东省四校高三上学期期末联考(理综)化学部分 题型:填空题
工业上生产高氯酸(沸点:90oC)时还同时生产了亚氯酸钠,其工艺流程如下: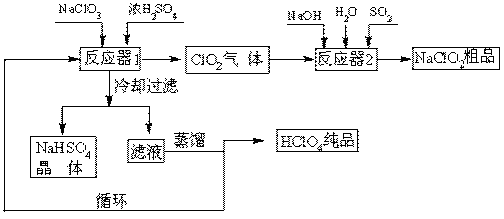
(1)冷却过滤的目的 。
(2)通入反应器2的SO2作用是 ;反应器2中发生反应的离子方程式为 。
(3)循环使用的物质是 。
(4)可以通过蒸馏滤液的方法得到高氯酸的原因可能是 。
(5)通过电解NaClO3水溶液的方法也可以制备NaClO4,进而可以制备HClO4,写出阳极的电极反应式 。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年广东省中山市高三上学期期末考试化学试卷 题型:选择题
(13分)工业上生产高氯酸时,还同时生产了一种常见的重要含氯消毒剂和漂白剂
亚氯酸钠(NaClO2),其工艺流程如下:
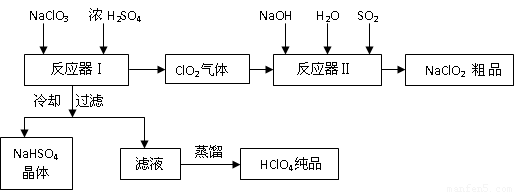
已知:
1.NaHSO4溶解度随温度的升高而增大,适当条件下可结晶析出。
2.高氯酸是至今为止人们已知酸中的最强酸,沸点90℃。
请回答下列问题
(1)反应器Ⅰ中发生反应的化学方程式为 ,冷却的目的是 ,能用蒸馏法分离出高氯酸的原因是 。
(2)反应器Ⅱ中发生反应的离子方程式为 。
(3)通入反应器Ⅱ中的SO2 用另一物质H2O2 代替同样能生成 NaClO2 ,请简要说明双氧水在反应中能代替SO2 的原因是
(4)Ca(ClO)2 、ClO2、NaClO、NaClO2 等含氯化合物都是常用的消毒剂和漂白剂是因为它们都具有 请写出工业上用氯气和NaOH溶液生产另一种消毒剂 NaClO的离子方程式
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com