
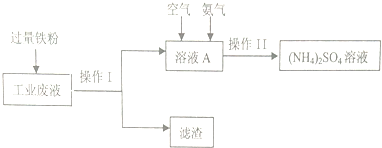
分析 实验目的是利用含硫酸铜的工业废液制备硫酸铵,根据流程可知,向废液中加入过量铁粉,将硫酸铜转化成硫酸亚铁,过滤后得到滤液A硫酸亚铁溶液,向硫酸亚铁溶液中通入空气和氨气,发生反应:4Fe2++O2+8NH3+10H2O=8NH4++4Fe(OH)3↓,将亚铁离子转化成氢氧化铁除去,从而得到硫酸铵,最后通过蒸发浓缩,得到硫酸铵溶液,据此进行解答.
解答 解:实验目的是利用含硫酸铜的工业废液制备硫酸铵,根据流程可知,向废液中加入过量铁粉,将硫酸铜转化成硫酸亚铁,过滤后得到滤液A硫酸亚铁溶液,向硫酸亚铁溶液中通入空气和氨气,发生反应:4Fe2++O2+8NH3+10H2O=8NH4++4Fe(OH)3↓,将亚铁离子转化成氢氧化铁除去,从而得到硫酸铵,最后通过蒸发浓缩,得到硫酸铵溶液,
(1)操作Ⅰ是将固体Fe、Cu与溶液分离,该操作方法为过滤;过滤得到的滤渣为Fe、Cu,滤液为硫酸亚铁溶液,
故答案为:过滤; Fe、Cu;
(2)工业废液中加入过量铁粉,铜离子与铁发生置换反应生成亚铁离子和铜,所发生反应的离子方程式为:Fe+Cu2+=Fe2++Cu,
故答案为:Fe+Cu2+=Fe2++Cu;
(3)操作Ⅱ得到的(NH4)2SO4溶液进行蒸发浓缩,需要的仪器除了酒精灯、铁架台、蒸发皿外,还需要用玻璃杯搅拌,
故答案为:玻璃棒;
(4)如图溶液A中发生反应的离子方程式为4Fe2++O2+8NH3+10H2O=8NH4++4Fe(OH)3↓,该反应中亚铁离子被氧化成铁离子,氧气从0价变为-2价,存在化合价变化,所以该反应是氧化还原反应,
故答案为:是;
(5)验(NH4)2SO4溶液中含有SO42-,可用稀盐酸和氯化钡溶液检验,操作方法为:取溶液少许于试管中,先加入足量稀盐酸,再加入氯化钡溶液,产生白色沉淀,则证明有SO42-存在,
故答案为:取溶液少许于试管中,先加入足量稀盐酸,再加入氯化钡溶液,产生白色沉淀,则证明有SO42-存在.
点评 本题考查了制备方案的设计,题目难度中等,明确实验目的及化学实验基本操作方法为解答关键,注意熟练掌握常见离子的检验方法、氧化还原反应的特征,试题培养了学生的分析能力及化学实验能力.


 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:选择题
| A. | 两种溶液中,水的电离程度:①>② | |
| B. | 分别中和等体积相同物质的量浓度的NaOH溶液,则消耗溶液的体积:①<② | |
| C. | 等体积的①、②溶液分别与足量铝粉反应,生成H2的质量:①=② | |
| D. | 将等体积的①、②溶液中分别稀释10倍后,溶液的pH:①>② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
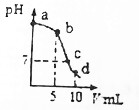 25℃时,向10mL 0.2mol•L-1 NaCN溶液中加入0.2mol•L-1盐酸,溶液pH随加入盐酸的体积变化情况如图所示.已知:Ka(HCN)=6.4×10-10.下列叙述错误的是( )
25℃时,向10mL 0.2mol•L-1 NaCN溶液中加入0.2mol•L-1盐酸,溶液pH随加入盐酸的体积变化情况如图所示.已知:Ka(HCN)=6.4×10-10.下列叙述错误的是( )| A. | a点时,CN-离子浓度大于其他点 | B. | b点时,c(HCN)>c(CN-) | ||
| C. | c点时,c(Na+)=c(Cl-)+c(CN-) | D. | d点时,溶液的c(H+)≈8×10-5mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
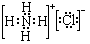 ;②B溶于水的过程中存在的可逆反应式为NH3+H2O
;②B溶于水的过程中存在的可逆反应式为NH3+H2O  NH3•H2O
NH3•H2O  NH4++OH-.
NH4++OH-.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解过程中阳极质量不变 | |
| B. | 电解过程中溶液的pH不断升高 | |
| C. | 此时向溶液中加入适量的Cu2O固体可使溶液恢复到电解前的状况 | |
| D. | 电解后两极产生的气体体积比为2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu2+、Cl-、Mg2+、NO3- | B. | K+、Cl-、Mg2+、SO42- | ||
| C. | Fe3+、Na+、NO3-、Al3+ | D. | HCO3-、NH4+、Ag+、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
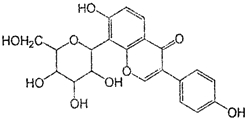
| A. | 该物质在一定条件下能发生消去反应、加成反应、取代反应 | |
| B. | 葛根素的分子式为C21H22O9 | |
| C. | 该物质在一定条件下能与碳酸氢钠溶液反应 | |
| D. | 一定条件下1 mol 该物质与H2反应最多能消耗7 mol H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 成分 | 含量/(mg/L) | 成分 | 含量/(mg/L) |
| Cl- | 18980 | Ca2+ | 400 |
| Na+ | 10560 | HCO3- | 142 |
| SO42- | 2560 | Mg2+ | 1272 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com