
用硫酸亚铁和硫酸铵制备硫酸亚铁铵,理论上硫酸亚铁和硫酸铵的物质的量之比应为 。实际上常使硫酸亚铁稍过量,其目的是防止 。
科目:高中化学 来源: 题型:阅读理解
| 实验序号 | 双氧水体积 | 催化剂 | 待测数据 |
| a | 15mL | 无 | |
| b | 15mL | 0.5g CuO | |
| c | 15mL | 0.5g MnO2 |
- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

 HCO3-+OH-
HCO3-+OH- HCO3-+OH-
HCO3-+OH-查看答案和解析>>
科目:高中化学 来源: 题型:

请根据题目要求回答下列问题。
(1)A的化学式为_______________,上述操作过程中用到的玻璃仪器有:①烧杯、②玻璃棒、③酒精灯、④温度计、⑤_______________。
(2)趁热过滤的目的是______________________________。
(3)结晶操作过程中应控制滤液酸性的原因是______________________________。
(4)已知硫酸亚铁铵〔(NH4)2Fe(SO4)2〕比硫酸亚铁稳定,常用在分析化学中。硫酸亚铁铵可用硫酸铵和硫酸亚铁反应制得。实验室利用硫酸亚铁铵溶液和草酸溶液反应生成草酸亚铁沉淀来制备草酸亚铁。写出硫酸亚铁铵溶液与草酸溶液反应的离子方程式:______________________________________。
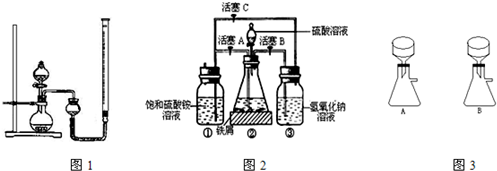
(5)草酸亚铁晶体(相对分子质量180)受热易分解。某课外小组设计如图的实验装置来检验其分解产物。

①该装置中最不合理的部分_______________(填字母),原因是____________________。
②改用正确装置实验开始后,B处变蓝,说明草酸亚铁晶体中有_______________;C处有白色沉淀,E处部分黑色粉末变为红色,说明草酸亚铁分解产生_______________(填化学式,下同);反应后在A处试管中有黑色固体粉末(混合物)产生,倒出时有燃烧现象。A处试管中的黑色固体粉末可能是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
硫酸亚铁铵的化学式为(NH4)2SO4·FeSO4·6H2O,商品名为莫尔盐。可由硫酸亚铁与硫酸铵反应生成硫酸亚铁铵,一般硫酸亚铁盐在空气中易被氧化,而形成莫尔盐后就比较稳定了。三种盐的溶解度(单位为g/100g水)如下表:
| 温度/℃ | 10 | 20 | 30 | 40 | 50 | 70 |
| (NH4)2SO4 | 73.0 | 75.4 | 78.0 | 81.0 | 84.5 | 91.9 |
| FeSO4·7H2O | 40.0 | 48.0 | 60.0 | 73.3 | - | - |
| (NH4)2SO4??FeSO4??6H2O | 17.2 | 26.4 | 33.0 | 46.0 | — | — |
实验室制取少量莫尔盐的流程如下:

试回答下列问题:
(1)步骤1中加入10%Na2CO3溶液的主要作用是除去铁屑表面的油污,简述其除去油污的原理
(2)将(NH4)2SO4与FeSO4混合后加热、浓缩,停止加热的时机
(3)步骤4中析出的晶体不含(NH4)2SO4和FeSO4的原因是 ,理论上制得的莫尔盐的质量为 。
(二)称取两份质量均为1.96g的该硫酸亚铁铵,制成溶液。用未知浓度的KMnO4酸性溶液进行滴定。
(1)滴定时,将KMnO4酸性溶液装在_______(填“酸式”或“碱式”)滴定管。试写出该滴定过程中的离子方程式:___ __;
(2)判断该反应到达滴定终点的现象为 ;
(3)假设到达滴定终点时,用去V mL KMnO4酸性溶液,则该KMnO4酸性溶液的浓度为 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
(11分)硫酸亚铁铵的化学式为(NH4)2SO4•FeSO4•6H2O,商品名为莫尔盐。可由硫酸亚铁与硫酸铵反应生成硫酸亚铁铵,一般硫酸亚铁盐在空气中易被氧化,而形成莫尔盐后就比较稳定了。三种盐的溶解度(单位为g/100g水)如下表:
温度/℃ | 10 | 20 | 30 | 40 | 50 | 70 |
(NH4)2SO4 | 73.0 | 75.4 | 78.0 | 81.0 | 84.5 | 91.9 |
FeSO4?7H2O | 40.0 | 48.0 | 60.0 | 73.3 | - | - |
(NH4)2SO4•FeSO4•6H2O | 17.2 | 26.4 | 33.0 | 46.0 | ― | ― |
(一)实验室制取少量莫尔盐的流程如下:
 |
试回答下列问题:
(1)步骤1中加入10%Na2CO3溶液的主要作用是除去铁屑表面的油污,简述其除去油污的原理
(2)将(NH4)2SO4与FeSO4混合后加热、浓缩,停止加热的时机
(3)步骤4中析出的晶体不含(NH4)2SO4和FeSO4的原因是 ,理论上制得的莫尔盐的质量为 。
(二)称取两份质量均为1.96g的该硫酸亚铁铵,制成溶液。用未知浓度的KMnO4酸性溶液进行滴定。
(1)滴定时,将KMnO4酸性溶液装在_______(填“酸式”或“碱式”)滴定管。试写出该滴定过程中的离子方程式:_ ___ __;
(2)判断该反应到达滴定终点的现象为 ;
(3)假设到达滴定终点时,用去V mL KMnO4酸性溶液,则该KMnO4酸性溶液的浓度为 mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com