
【题目】已知某粗盐样品含有Na2SO4、MgCl2、CaCl2等杂质。实验室提纯流程如下:
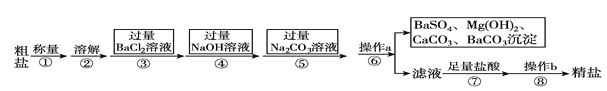
(1)操作a的名称为________,在操作b中玻璃棒的作用是_____________________。
(2)进行步骤③后,判断BaCl2过量的方法是______________________________(写出步骤、现象)。
(3)步骤⑦中能用稀硫酸代替稀盐酸吗?________(填“能”或“不能”),原因是_____________。
(4)某氯化钾样品中含杂质硫酸钾,为了除去硫酸钾,要做以下实验:
A.向滤液中滴加稀盐酸,边滴边振荡至不再产生气体
B.将氯化钾样品溶于适量蒸馏水,配成溶液
C.过滤,将白色沉淀滤出
D.向溶液中加入过量碳酸钾溶液,边滴边振荡至不再产生白色沉淀
E.向溶液中加入过量氯化钡溶液,边滴边振荡至不再产生沉淀
F.将滤液蒸干,得到晶体
①正确的实验操作顺序为______________(填写序号)。
②进行F操作时用到的仪器主要有____________________________________。
【答案】过滤 搅拌,使滤液受热均匀,防止液体飞溅 取少量上层清液于试管中,滴入Na2SO4溶液,若有白色沉淀产生,则Bacl2过量 不能 引入硫酸根杂质离子 BEDCAF 酒精灯、三脚架(或带铁圈的铁架台)、蒸发皿、玻璃棒、坩埚钳
【解析】
实验流程为:粗盐样品含有Na2SO4、MgCl2、CaCl2等杂质,加入过量的氯化钡,可以将硫酸根离子除去,但是会引入钡离子杂质离子,加入过量氢氧化钠溶液的目的是除去氯化镁,加入过量的碳酸钠溶液的目的除去杂质CaCl2和加入的过量试剂BaCl2,过滤,将得到的沉淀全部滤出,得到的滤液是含有氯化钠、碳酸钠、氢氧化钠等的混合物,加入足量的盐酸,可以除去碳酸根离子、氢氧根离子等杂质离子,最后即可获得较为纯净的氯化钠。
(1)实现固体和液体的分离的步骤a是过滤,操作b是对氯化钠溶液蒸发结晶获得氯化钠晶体的过程,此时玻璃棒的作用是:搅拌,使滤液受热均匀,防止液体飞溅,故答案为:过滤;搅拌,使滤液受热均匀,防止液体飞溅;
(2)过量的氯化钡会将全部的硫酸根离子沉淀完毕,只要是氯化钡剩余,则氯化钡会与硫酸钠反应出现白色沉淀,所以判断BaCl2已过量的方法是取少量上层清液于试管中,滴入Na2SO4溶液,若有白色沉淀产生,则Bacl2过量,故答案为:取少量上层清液于试管中,滴入Na2SO4溶液,若有白色沉淀产生,则BaCl2过量;
(3)加入过量的碳酸钠溶液的目的除去杂质CaCl2和加入的过量试剂BaCl2,加入足量的盐酸,可以除去碳酸根离子、氢氧根离子等杂质离子,最后即可获得较为纯净的氯化钠,若加入足量的硫酸,则会在氯化钠中引入硫酸根杂质离子,故答案为:不能;引入硫酸根杂质离子;
(4)①样品溶于水配制的溶液中含有KCl、K2SO4,其中SO42-为杂质,先加入过量的 BaCl2溶液,除去硫酸根离子,反应方程式为:SO42-+Ba2+=BaSO4↓,得到固体A为:BaSO4,滤液B中含有KCl、过量的BaCl2,向滤液中加入过量K2CO3溶液,除去过量的Ba2+离子,得到固体为BaCO3,滤液中溶质为K2CO3和KCl,然后向溶液中加入过量HCl溶液,除去杂质碳酸根离子,发生反应:CO32-+2H+=H2O+CO2↑,则气体为CO2,然后蒸发溶液,溶液中HCl挥发,最终可得到KCl晶体,故答案为:BEDCAF;
②F操作为蒸发,用到的仪器有酒精灯、三脚架(或带铁圈的铁架台)、蒸发皿、玻璃棒、坩埚钳,故答案为:酒精灯、三脚架(或带铁圈的铁架台)、蒸发皿、玻璃棒、坩埚钳。


科目:高中化学 来源: 题型:
【题目】由两种有机物组成的混合物,在一定的温度和压强下完全气化为气体.在相同的温度和压强下,只要混合气体体积一定,那么无论两物质以何种比例混合,其完全燃烧时所消耗的氧气体积就是一定的,符合这种情况的可能组合是:
A. 乙醇(![]() )和乙酸(
)和乙酸(![]() ) B. 乙醛(
) B. 乙醛(![]() )和甲醇(
)和甲醇(![]() )
)
C. 丙醛(![]() )和甘油(
)和甘油(![]() ) D. 丙酮(
) D. 丙酮(![]() )和丙二醇(
)和丙二醇(![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为部分元素在元素周期表中的相对位置。据此回答相关问题:

(1)其中非金属性最强的是__________(填元素符号)。
(2)P、S两种元素的最高价氧化物对应的水化物的酸性:H3PO4________H2SO4(填“>”、“<”或“=”)
(3)N位于元素周期表中的第___________族。
(4)F、Cl两种元素氢化物的稳定性:HF_______HCl(填“>”、“<”或“=”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关共价键键参数的的比较中,不正确的是( )
A. 键能:C—N < C=N < C≡N
B. 键长:I—I > Br—Br > Cl—Cl
C. 分子中的键角:H2O > NH3
D. 乙烯分子中碳碳键的键能:σ键 > π键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸桂酯(G)具有风仙花香气味,可用于调配果味食品香精及日用化妆品香精。一种用芳香烃A合成F的工艺路线如下:
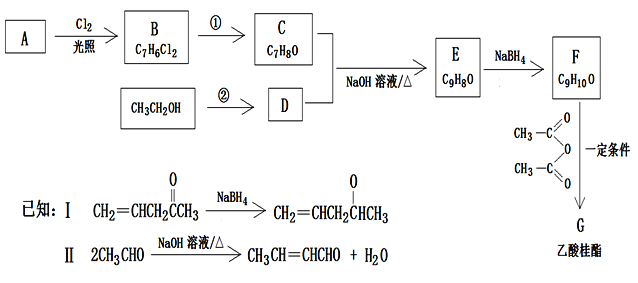
回答下列问题:
(1)E结构简式为____________。C的名称是____________
(2)①的“反应条件”为________;②的反应类型为__________.
(3)F中所含官能团的名称为___________
(4)写出F![]() G反应的化学方程式___________
G反应的化学方程式___________
(5)F的同分异构体中,同时满足下列条件的有__种(不考虑立体异构);①能与FeCl3溶液显蓝紫色,②苯环上有两个取代基,含一个碳碳双键。其中核磁共振氢谱有5组峰,且峰面积之比为1:2:2:2:3的结构简式为__________.
(6)观察本题合成路线的试剂及条件,利用以上合成路线中的相关信息,请写出由HCHO、CH3CHO、制备CH2=CHCH2OOCCH3的合成路线图。(反应物及产物写成结构简式)________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应2KMnO4=K2MnO4+MnO2+O2↑已知158g KMnO4反应生成了16g O2,则固体残余物的质量是
A. 16g B. 32g C. 126g D. 142g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学反应原理研究碳、氮的单质及其化合物的反应对缓解环境污染、能源危机具有重要意义。
(1)乙醇是一种重要的燃料,工业上利用乙烯制酒精:C2H4(g)+H2O(l)=C2H5OH(l) ΔH,已知乙烯、乙醇的燃烧热分别是1411.0kJ·mol-1、1366.8 kJ·mol-1,则ΔH=_____________。
(2)用Cu2Al2O4作催化剂,一定条件下发生反应:CO2(g)+CH4(g)![]() CH3COOH(g),温度与催化剂的催化效率和乙酸的生成速率的关系如图,回答下列问题:
CH3COOH(g),温度与催化剂的催化效率和乙酸的生成速率的关系如图,回答下列问题:
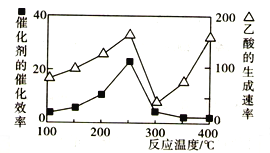
①200~250℃时,乙酸的生成速率升高的主要原因是____________________________。
②300~400℃时,乙酸的生成速率升高的主要原因是____________________________。
(3)甲醇作为一种重要的化工原料。在一定条件下可利用甲醇羰基化法制取甲酸甲酯,其反应原理可表示为CH3OH(g)+CO(g)![]() HCOOCH3(g) ΔH=-29.1kJ/mol。向体积为1L的密闭容器中充入3mol CH3OH(g)和3mol CO(g),测得容器内的压强(p: kPa) 随时间(t: min) 的变化关系如图中Ⅰ、Ⅱ、Ⅲ曲线所示:
HCOOCH3(g) ΔH=-29.1kJ/mol。向体积为1L的密闭容器中充入3mol CH3OH(g)和3mol CO(g),测得容器内的压强(p: kPa) 随时间(t: min) 的变化关系如图中Ⅰ、Ⅱ、Ⅲ曲线所示:
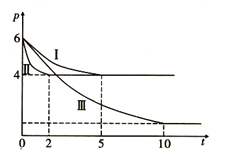
①Ⅱ和Ⅰ相比,Ⅱ中改变的反应条件是_______________________。
②Ⅲ和Ⅰ相比,Ⅲ中改变的反应条件是_________________,判断的理由是________________________。
③反应Ⅰ在5min 时达到平衡,在此条件下从反应开始到达到平衡时v(CH3OH)= ________________。
④反应Ⅱ在2min 时达到平衡,平衡常数K(Ⅱ)= ______________。在体积和温度不变的条件下,在上述反应达到平衡Ⅱ时,再往容器中加入2mol CH3OH 和1mol HCOOCH3后,平衡_______移动(填“正向”“逆向”或“不”),原因是____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学实验中若使某步中的有害产物作为另一步的反应物,形成一个循环,则可不再向环境排放该种有害物质。在如图所示有编号的反应中,属于氧化还原反应的有
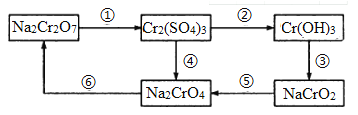
A. 6个 B. 5个 C. 4个 D. 3个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.2 mol MnO2和50 mL 12 mol/L盐酸混合后缓缓加热,反应完全后向留下的溶液中加入足量AgNO3溶液,生成AgCl沉淀物质的量为(不考虑盐酸的挥发)
A. 等于0.3 mol B. 小于0.3 mol
C. 大于0.3 mol D. 以上结论都不正确
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com