
【题目】已知Ca3(PO4)2与SiO2、C高温共热可以反应得到CaSiO3、P4蒸气和CO.反应如下:Ca3(PO4)2+SiO2+C![]() CaSiO3+P4↑+CO↑
CaSiO3+P4↑+CO↑
(1)配平该反应方程式,并标出电子转移方向和数目____________.
_____Ca3(PO4)2+_____SiO2+_____C![]() _____CaSiO3+_____P4↑+_____CO↑
_____CaSiO3+_____P4↑+_____CO↑
(2)该反应中被还原的元素是_____,氧化产物是_____.
(3)每消耗24.0g碳时,有_____个电子发生转移,生成P4_____g.
(4)反应所得混合气体,折算成标况下,其气体密度为_____g/L(保留两位小数).与该反应中涉及到的磷元素相同主族的氮元素,是造成水体富营养化的主要原因.若某污水中NH4Cl含量为180mg/L.
(5)写出NH4Cl的电子式_____.
(6)为除去废水中的NH4+,向103L该污水中加入0.1mol/LNaOH溶液,发生如下反应:NH4++OH﹣→NH3+H2O.则理论上需要NaOH溶液的体积为_____L(计算结果保留两位小数)
【答案】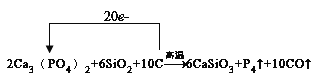 2 6 10 6 1 10 P CO 4NA 24.8 1.64
2 6 10 6 1 10 P CO 4NA 24.8 1.64 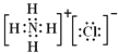 33.64
33.64
【解析】
(1)在此反应中Ca3(PO4)2中P元素价态从+5降低到0价的P4,化合价降低了20,C从0价升高到+2价的CO,化合价升高了+2价,最小公倍数为20,故P4前系数为1,CO前系数为10,并根据原子守恒进行配平;
(2)根据Ca3(PO4)2中P元素的化合价由+5价降低为0,化合价降低,故为氧化剂,氧化剂具有氧化性被还原得到的是还原产物P4分析;
(3)结合元素化合价的变化及电子守恒来计算;
(4)据ρ=m/V计算;
(5)氯化铵为离子晶体,由氨根离子与氯离子通过离子键结合在一起;
(6)由 NH4Cl~~~~~NaOH,
53.5g 1mol
180mg·L-1×103 L×103 g/mg 0.1mol·L-1×V,解之得:污水中的氨气被空气带走,有利于NH3·H2O![]() NH3+H2O的平衡正向移动;
NH3+H2O的平衡正向移动;
(1)在此反应中Ca3(PO4)2中P元素价态从+5降低到0价的P4,化合价降低了20,C从0价升高到+2价的CO,化合价升高了+2价,最小公倍数为20,故P4前系数为1,CO前系数为10,并根据原子守恒配平,故方程式2Ca3(PO4)2+6SiO2+10C![]() 6CaSiO3+P4↑+10CO↑故方程式前面的系数为:2;6;10;6;1;10;单线桥表示
6CaSiO3+P4↑+10CO↑故方程式前面的系数为:2;6;10;6;1;10;单线桥表示
故答案为:2;6;10;6;1;10;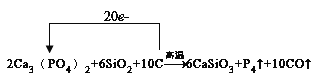
(2)据Ca3(PO4)2中P元素的化合价由+5价降低为0,化合价降低,故作氧化剂,又因为氧化剂具有氧化性被还原,故P元素被还原;C元素由0价升高到+2价的CO,化合价升高,做还原剂,得到的CO是氧化产物,
故答案为:P;CO;
(3)每消耗24.0g碳时,转移电子为![]() ×(2﹣0)=4mol,N=nNA=4NA,由反应可知,消耗10molC生成1molP4,其质量为0.2mol×124g/mol=24.8g
×(2﹣0)=4mol,N=nNA=4NA,由反应可知,消耗10molC生成1molP4,其质量为0.2mol×124g/mol=24.8g
故答案为:4NA;24.8;
(4)由反应可知,混合气体的质量为24.8g+2mol×28g/mol=80.8g,标况下体积为2.2mol×22.4L/mol=49.28L,所以密度为![]() =1.64g/L
=1.64g/L
故答案为:1.64
(5)氯化铵是离子化合物,由氨根离子与氯离子构成,电子式为: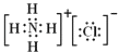 ,
,
故答案为: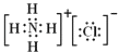 ;
;
(6)由 NH4Cl~~~~~NaOH,
53.5g 1mol
180mg/L×103 L×103 g/mg 0.1mol/L×V,
![]() =
=![]() 解之得:V=33.64L
解之得:V=33.64L
故答案为:33.64.


 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科目:高中化学 来源: 题型:
【题目】书写下列描述中所发生化学反应的离子方程式
(1)稀硫酸与氢氧化钡反应:_________________________________。
(2)向澄清石灰水中加入少量碳酸氢钠溶液:___________________________。
(3)向硫酸氢钠溶液中加氢氧化钠溶液至中性:____________________。
(4)生活中可以用醋酸除去水垢:________________________________________。
(5)西汉刘安《淮南万毕术》中记载“曾青得铁则化为铜”,是湿法炼铜的最早描述:______________________。
(6)向饱和的碳酸钠溶液中通入CO2生成碳酸氢钠的沉淀______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)同温同压下,a g甲气体和2a g乙气体所占体积之比为1∶2,甲和乙的密度之比为______。
(2)二氧化硫、氢气、二氧化碳组成的混合气体在同温、同压下与笑气(N2O)的密度相同,则该混合气体中二氧化硫、氢气、二氧化碳的体积比可能为_______(填字母)。
A.42:20:13 B.22:1:14 C.13:8:13 D.21:10:12
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体混合物X可能是由Na2SiO3、Fe、Na2CO3、 BaCl2中的两种或两种以上的物质组成。某兴趣小组为探究该固体混合物的组成,设计实验方案如下图所示(所加试剂均过量)。

下列说法不正确的是:
A. 气体A一定是混合气体
B. 沉淀A一定是H2SiO3
C. 白色沉淀B在空气中逐渐变灰绿色,最后变红褐色
D. 该固体混合物一定含有Fe、Na2CO3、BaCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列各组物质:
①红磷、白磷 ②![]() 、
、![]() ③
③![]() 、
、![]() ④
④![]() 、
、![]() ⑤
⑤![]() 、
、![]() ⑥
⑥![]() 、
、![]()
其中属于同位素的是______________,属于同素异形体的是___________,属于同种元素的不同种微粒的是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气的治理是减轻空气污染的有效途径。科学家研究发现TiO2的混凝土或沥青可以适度消除汽车尾气中的氮氧化物,其原理如下。下列关于“消除”过程的叙述错误的是

A. 部分光能转变为化学能
B. 消除总反应为:4NOx+(5-2x)O2+2H2O![]() 4HNO3
4HNO3
C. 使用纳米TiO2,产生的光生电子和空穴更多,NOx消除效率更高
D. 1 mol![]() 比1 mol羟基(·OH)多9NA个电子(NA为阿伏伽德罗常数)
比1 mol羟基(·OH)多9NA个电子(NA为阿伏伽德罗常数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某过碳酸钠中含有少量过氧化钠,甲、乙两位同学各称取一定质量的该样品,并用如下图所示仪器测定样品的纯度。仪器的连接顺序,甲同学:⑤—⑧—③—⑦—④;乙同学:⑤—③—②。装置气密性良好。

已知:过碳酸钠(Na2CO4)、过氧化钠分别跟足量稀硫酸反应的化学方程式如下:
2Na2CO4+2H2SO4=2Na2SO4+2CO2↑+O2↑+2H2O;
2Na2O2+2H2SO4=2Na2SO4+O2↑+2H2O。
(1)甲同学选用的装置_________(填序号)是没有必要的。实验中甲同学称取固体样品质量为a g,测得气体体积为V L,实验条件下的气体摩尔体积为Vm(L/mol),则Na2CO4的质量分数为______(用含a、V、Vm的代数式表示)。
(2)乙同学想通过实验测得的数据是_______。按他测得的数据计算出的实验结果有可能偏低,原因是________________。
(3)为了测得准确的实验数据,请你将乙同学的实验设计进行改进,写出你所选用仪器的连接顺序(每种仪器最多使用一次,也可以不用。按从左到右排列)_____________(填序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA是阿伏加德罗常数的值。下列关于反应“C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O”的说法正确的是
CO2↑+2SO2↑+2H2O”的说法正确的是
A. IL pH=2的H2SO4溶液中含有的H+数目为0.02NA
B. 含0.2molH2SO4的浓硫酸与足量炭充分反应生成气体分子总数为0.3NA
C. 生成SO24.48L(标况下)时转移电子数为0.4NA
D. 8.8gCO2中共用电子数目为0.8NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有如图所示的离子晶体空间结构示意图。

(1)以M代表阳离子,以N代表阴离子,写出各离子晶体的组成表达式:A________,B________,C_________,D________。
(2)已知FeS2晶体(黄铁矿的主要成分)具有A的空间结构。
①FeS2晶体中存在的化学键类型是 ________。
②若晶体结构A中相邻的阴、阳离子的最小距离为a cm,且用NA代表阿伏加德罗常数,则FeS2晶体的密度是________g/cm3。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com