(2010?南开区一模)乙醇是重要的化工原料和液体燃料,可以利用下列反应制取乙醇:
2CO
2(g)+6H
2(g) CH
3CH
2OH(g)+3H
2O(g)
(1)写出该反应的平衡常数表达式:K=
| c(CH3OH)c3(H2O) |
| c2(CO2)c6(H2) |
| c(CH3OH)c3(H2O) |
| c2(CO2)c6(H2) |
.
(2)请说明以CO
2为原料合成乙醇的优点是
废弃物利用,有利于环保
废弃物利用,有利于环保
(只要求写出一条).
(3)在一定压强下,测得该反应的实验数据如下表:
温度/℃CO2转化率/%
n(H2)/n(CO2) |
500 |
600 |
700 |
800 |
| 1.5 |
45 |
33 |
20 |
12 |
| 2.0 |
60 |
43 |
28 |
15 |
| 3.0 |
83 |
62 |
37 |
22 |
①该反应是
放热
放热
反应(填“吸热”或“放热”).
②一定条件下,若提高氢碳比[n(H
2)/n(CO
2)],则CO
2的转化率
增大
增大
;平衡常数K
不变
不变
.(填“增大”、“减小”、或“不变”)
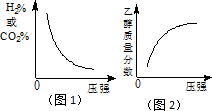
(4)在下图的坐标系中作图说明压强变化对该反应化学平衡的影响,并对图中横坐标、纵坐标的含义作必要的标注.

(5)一种乙醇燃料电池中发生的化学反应为:在酸性溶液中乙醇与氧作用生成水和二氧化碳.该电池的负极反应式为:
C2H5OH-12e-+3H2O=2CO2+12H+
C2H5OH-12e-+3H2O=2CO2+12H+
.
(6)25℃、101kPa下,H
2(g)、C
2H
4(g)和C
2H
5OH(l)的燃烧热分别是285.8kJ?mol
-1、1411.0kJ?mol
-1和1366.8kJ?mol
-1,请写出由C
2H
4(g)和H
2O(l)反应生成C
2H
5OH(l)的热化学方程式
C2H4(g)+H2O(l)═C2H5OH(l);△H=-44.2 kJ/mol-1
C2H4(g)+H2O(l)═C2H5OH(l);△H=-44.2 kJ/mol-1
.


 ;
;

 阅读快车系列答案
阅读快车系列答案