
分析 (1)碳酸钙分解生成氧化钙,氧化钙与水反应生成氢氧化钙,氢氧化钙与氯化铵在加热条件下反应生成氨气,氨气催化氧化生成一氧化氮,一氧化氮氧化生成二氧化氮,二氧化氮与水反应生成硝酸和一氧化氮,硝酸与氨气反应生成硝酸铵;
(2)氨气能使湿润的红色石蕊试纸变蓝,根据铵离子的检验方法进行判断:加入滴加NaOH溶液并加热,产生的气体能使湿润的红色石蕊试液变蓝,则原溶液中一定含有NH4+.
解答 解:(1)碳酸钙分解生成氧化钙,化学方程式为:CaCO3 $\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑;氧化钙与水反应生成氢氧化钙,化学方程式为:CaO+H2O=Ca(OH)2;
氢氧化钙与氯化铵在加热条件下反应生成氨气,化学方程式为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
氨气催化氧化生成一氧化氮,化学方程式为:4NH3+5O2$\frac{\underline{\;催化剂\;}}{△}$4NO+6H2O;
一氧化氮氧化生成二氧化氮,化学方程式:2NO+O2=2NO2;
二氧化氮与水反应生成硝酸和一氧化氮,化学方程式:3NO2+H2O=2HNO3+NO;
硝酸与氨气反应生成硝酸铵,化学方程式:NH3+HNO3=NH4NO3;
故答案为:①CaCO3 $\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑;
②CaO+H2O=Ca(OH)2;
③2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
④4NH3+5O2$\frac{\underline{\;催化剂\;}}{△}$4NO+6H2O;
⑤2NO+O2=2NO2;
⑥3NO2+H2O=2HNO3+NO;
⑦NH3+HNO3=NH4NO3;
(2)检验铵根离子,可以使用氢氧化钠溶液,氢氧化钠溶液中的氢氧根离子能与铵根离子结合产生氨气,NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O,氨气的水溶液呈碱性,能使润湿的红色石蕊试纸变蓝;
故答案为:取少量溶液于试管中,加入浓NaOH溶液,加热,看是否能够产生使湿润的红色石蕊试纸变蓝的气体,若能产生,证明溶液中含有NH4+.
点评 本题以硝酸铵的制备为载体,考查了化学方程式的书写、铵根离子的检验,明确氮及其化合物性质是解题关键,题目难度不大.


 优生乐园系列答案
优生乐园系列答案科目:高中化学 来源: 题型:选择题

| A. | 图1中,插入海水中的铁棒,越靠近底端腐蚀越严重 | |
| B. | 图2中,往烧杯中滴加几滴KSCN溶液,溶液变血红色 | |
| C. | 图3中,开关由M改置于N时,Cu-Zn合金的腐蚀速率增大 | |
| D. | 图4中,采用了牺牲阳极的阴极保护法来防止地下钢铁管道的腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 每消耗1molH2(g)释放483.6kJ的能量 | |
| B. | 每生成1molH2O(g)释放483.6kJ的能量 | |
| C. | 方程式中H2(g)计量数改变△H值不变 | |
| D. | 同条件下2molH2O(g)完全分解吸收的能量为483.6kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=1的溶液中:Fe3+、NO3-、SO42-、Na+ | |
| B. | 使酚酞变红色的溶液中:Na+、Al3+、HCO3-、NO3- | |
| C. | 能与金属铝反应生成氢气的溶液中:NH4+、Al3+、NO3-、Cl- | |
| D. | 无色透明的溶液中:K+、Cu2+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
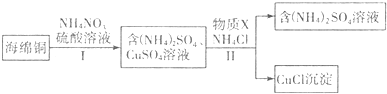
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶剂的质量为:(dV-0.208Vc)g | |
| B. | 溶质的质量分数为:$\frac{208c}{d}$% | |
| C. | 溶质和溶剂的质量之比为:0.208Vc:(dV-0.208Vc) | |
| D. | Cl-的物质的量为:0.002Vc mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
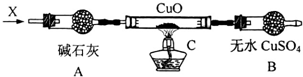 铜是常见的变价金属.为了比较正一价铜和正二价铜的稳定性,并研究氧化铜的氧化性,某化学小组的同学进行了以下实验.
铜是常见的变价金属.为了比较正一价铜和正二价铜的稳定性,并研究氧化铜的氧化性,某化学小组的同学进行了以下实验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | B电极发生还原反应 | |
| B. | A电极上发生的一个电极反应为:2Li++S8+2e-═Li2S8 | |
| C. | 每生成1mol Li2S8转移0.25mol电子 | |
| D. | 电子从B电极经过外电路流向A电极,再经过电解质流回B电极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 40% | B. | 50% | C. | 80% | D. | 90% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com