
【题目】(1)将碳酸钙、稀盐酸、铁、氧气四种物质填写到下面的适当位置。

___________、___________、___________、___________。
(2)从(1)中的四种物质中选出一种或几种为反应物,按下述反应类型,各写一个化学方程式。
①分解反应:_______________________________;
②化合反应:_______________________________;
③置换反应:_______________________________;
④复分解反应:_______________________________。
【答案】碳酸钙 铁 氧气 稀盐酸 CaCO3![]() CaO+CO2↑ 3Fe+2O2
CaO+CO2↑ 3Fe+2O2![]() Fe3O4 Fe+2HClFeCl2+H2↑ CaCO3+2HClCaCl2+H2O+CO2↑
Fe3O4 Fe+2HClFeCl2+H2↑ CaCO3+2HClCaCl2+H2O+CO2↑
【解析】
(1)碳酸钙属于化合物,铁属于金属单质,氧气属于非金属单质,稀盐酸属于混合物;综上所述,本题答案是:碳酸钙, 铁, 氧气, 稀盐酸。
(2) ①CaCO3可以受热分解,反应的方程式为:CaCO3![]() CaO+CO2↑;
CaO+CO2↑;
②Fe和O2可以化合生成Fe3O4:反应的方程式为:3Fe+2O2![]() Fe3O4;
Fe3O4;
③盐酸和铁可以发生置换反应,反应的方程式为:Fe+2HClFeCl2+H2↑ ;
④CaCO3与盐酸可以发生复分解反应,反应的方程式为:CaCO3+2HClCaCl2+H2O+CO2↑;
综上所述,本题答案是:CaCO3![]() CaO+CO2↑;3Fe+2O2
CaO+CO2↑;3Fe+2O2![]() Fe3O4;Fe+2HClFeCl2+H2↑ ;CaCO3+2HClCaCl2+H2O+CO2↑。
Fe3O4;Fe+2HClFeCl2+H2↑ ;CaCO3+2HClCaCl2+H2O+CO2↑。


科目:高中化学 来源: 题型:
【题目】氨基羧酸盐在工业、农业、生活中都有着十分广泛的应用。氨基甲酸铵(NH2COONH4)可用做肥料、灭火剂、洗涤剂等,甘氨酸亚铁[(NH2CH2COO)2Fe]可用作补铁剂等。
已知:i. 氨基甲酸铵:白色固体,易分解,易水解;甘氨酸亚铁:易溶于水,难溶于乙醇。
ii. 甘氨酸:易溶于水,微溶于乙醇,两性化合物。
iii. 柠檬酸:易溶于水和乙醇,有较强酸性和还原性。
实验室制备方法如下:
I.制备氨基甲酸铵:反应的化学方程式为:2NH3(g)+CO2(g) ![]() NH2COONH4(g) △H<0
NH2COONH4(g) △H<0
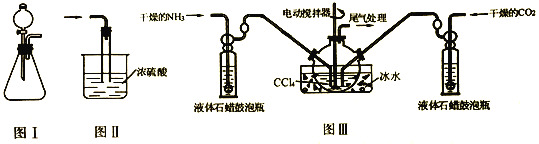
(1)图Ⅰ装置制备NH3,则所选试剂为_________________
(2)图Ⅲ装置制备氨基甲酸铵,把氨气和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中。(注:四氯化碳与液体石蜡均为惰性介质。)
①从反应后的混合物中分离出产品的实验操作是_______________(填操作名称)
②图Ⅱ装置进行尾气处理,则双通玻璃管的作用________________
③液体石蜡鼓泡瓶的作用是________________
④发生器用冰水冷却的原因是________________
II.制备(NH2CH2COO)2Fe:装置如图(夹持和加热仪器已省略), 用CO2气体将装置中空气排净,加入药品后,滴入柠檬酸并加热。反应结束后过滤,将滤液蒸发浓缩,加入乙醇,过滤、干燥得到产品。
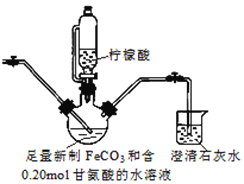
(3)烧杯中澄清石灰水的作用是_______________。
(4)柠檬酸可调节pH,体系pH与产率的关系如下表:
实验 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
体系pH | 4.0 | 4.5 | 5.0 | 5.5 | 6.0 | 6.5 | 7.0 | 7.5 |
产率/% | 65.74 | 74.96 | 78.78 | 83.13 | 85.57 | 72.98 | 62.31 | 56.68 |
分析pH过低使产率下降的原因是___________;柠檬酸的作用还有_____(填序号)。
a.作反应终点指示剂 b.防止二价铁被氧化 c. 作催化剂 d. 促进FeCO3溶解
(5)乙醇的作用是________________。
(6)若产品的质量为m g,则产率为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于晶体的下列说法正确的是
A. 任何晶体中,若含有阳离子就一定有阴离子
B. 原子晶体中只含有共价键
C. 原子晶体的熔点一定比金属晶体的高
D. 离子晶体中只含有离子键,不含有共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.氟元素为非金属性最强的元素,氟无正价
B.第ⅠA、ⅡA族元素都具有较强的金属性
C.非金属性:F>Cl>Br>I,则酸性HF>HCl>HBr>HI
D.碱性:NaOH<Mg(OH)2<Al(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室利用下图装置制备H2S气体,并探究H2S的有关性质。回答下列问题:
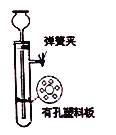
(1)实验开始时,检查装置气密性的方法是_________________。
(2)若装置不漏气,加入装置中的药品为_________(填字母)。
a.FeS和稀硫酸 b.Na2S和稀硫酸 C.ZnS和稀硝酸d.CuS和稀盐酸
该反应的离子方程式为_________________。
(3)打开弹簧夹使反应发生,将生成的H2S气体通入1.0mol/LFe(NO3)3溶液中,观察到有浅黄色固体析出。为探究实际参与该反应的微粒种类,设计如下图装置:

若A装置中加入1.0mol/L的FeCl3溶液,并测其pH=1,则B装置中加入的试剂是______;实验观察到A、B中均有浅黄色固体析出,则H2S与Fe(NO3)3溶液反应的离子方程式为_______。
(4)实验结束时,使反应停止的操作是______;此时反应停止的原因是______________。
(5)常温下,以Na2S为样品,选择合理的仪器和试剂设计实验①证明氢硫酸为二元弱酸②测量并估算氢硫酸的Ka2(H2S),则需要的主要计量仪器为电子天平、容量瓶、_____、_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图甲是一种利用微生物将废水中的尿素[CO(NH2)2]的化学能直接转化为电能,并生成对环境友好物质的装置,同时利用此装置的电能在铁上镀铜,下列说法中正确的是
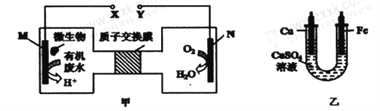
A. 铁电极应与Y相连接
B. H+透过质子交换膜由右向左移动
C. 当N电极消耗0.25mol气体时,则铁电极增重16g
D. M电极反应式:H2NCONH2+H2O-6e-=CO2↑+N2+6H+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com